| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Mehr als drei Viertel aller bekannten Elemente sind Metalle. Eine Stufenlinie im Periodensystem markiert ungefähr die Grenze zwischen Metallen und Nichtmetallen. Die Nichtmetalle stehen in der rechten oberen Ecke des Periodensystems (außer Wasserstoff). Die Grenze ist nicht scharf; die Elemente in ihrer Nähe sind weder typische Metalle noch typische Nichtmetalle, ihre Eigenschaften liegen zwischen den Extremen.
Zu den wenigen (Halb-) Nichtmetallen gehören z.B. die Edelgase, die Halogene, Sauerstoff, Schwefel, Stickstoff, Kohlenstoff und Silizium, diese Substanzen haben sehr unterschiedliche Eigenschaften. Viele Nichtmetalle sind bei RT gasförmig, andere sind fest; Brom wiederum ist flüssig. Manche sind farblos andere leicht gefärbt, wieder andere dunkel glänzend.
Demgegenüber zeigen Metalle überraschend einheitliche Eigenschaften. Sie sind, mit Ausnahme des flüssigen Quecksilbers, bei RT alle fest, und leiten im flüssigen wie auch im festen Zustand den elektrischen Strom. Im Unterschied zu den Salzschmelzen und den Salzlösungen nimmt bei Metallen die Leitfähigkeit mit zunehmender Temperatur ab. Metalle verändern sich nicht wenn sie den elektrischen Strom leiten; es findet also keine Elektrolyse statt. Alle Metalle mit gleicher Oberfläche zeigen den typischen metallischen Glanz. Schließlich sind Metalle wasser-unlöslich (einige Metalle reagieren mit Wasser und bilden wasserlösliche Verbindungen).
Diese übereinstimmenden Eigenschaften beruhen auf dem ähnlichen Aufbau der
Metalle und damit auf Gemeinsamkeiten im Atomaufbau. Im Periodensystem der
Elemente finden sich die Metalle links und unten.
Der Metallische Charakter der Elemente nimmt innerhalb der Periode von links nach
rechts ab und innerhalb der Gruppe von oben nach unten.
Gerade umgekehrt verhält es sich mit der Elektronegativität der Elemente.
Metallatome besitzen verhältnismäßig geringe Elektronegativitätswerte.
Metallatome besitzen relativ locker gebundene Valenzelektronen und bilden Gitter, die man als Metallgitter bezeichnet. Die Bindung zwischen den Atomen eines Metallgitters kommt dadurch zustande, dass benachbarte Atome an den gleichen Elektronen Anteil haben. Anders als bei der Atombindung, sind aber die gemeinsamen Elektronen, wenigstens zum Teil, nicht an bestimmte Atome gebunden, sondern können innerhalb des Gitters leicht ihre Plätze wechseln. Bei Anlegen einer elektrischen Spannung verschieben sich diese beweglichen Elektronen. Darauf beruht die gute elektrische Leitfähigkeit der Metalle. Die leicht beweglichen Elektronen übertragen aber auch die bei höheren Temperaturen verstärkte Schwingungsenergie leicht auf andere Atome. Metalle besitzen daher eine gute Wärmeleitfähigkeit.
Die Metallgitter unterscheiden sich von den Ionengittern der Salze in einigen wesentlichen Eigenschaften. Salzkristalle z.B. zerspringen sehr leicht, wenn man versucht sie zu verformen. Im Salzgitter kommen beim Verschieben der Schichten gegeneinander Ionen gleicher Ladung nebeneinander zu liegen, welche sich gegenseitig abstoßen, so dass das Ionengitter zerspringt. Die Metallgitter besitzen demgegenüber keine verschieden geladene Ionen, die sich beim Verschieben gegenseitig abstoßen könnten. Die Schichten der Metallgitter lassen sich daher gegeneinander verschieben ohne dass der Zusammenhalt verloren geht. Das Metall lässt sich verformen (es ist mehr oder weniger duktil).
Da die Metallgitter immer nur aus Teilchen einer Art bestehen, sind sie relativ unkompliziert aufgebaut. Da alle Teilchen gleiche Radien besitzen, herrschen hohe Koordinationszahlen (8 bzw. 12) vor. Die Teilchen werden möglichst eng gepackt. Es entstehen häufig sogenannte hexagonale oder kubisch dichteste Kugelpackungen. Dabei ist innerhalb einer Schichtebene jedes Teilchen von sechs Nachbarteilchen umgeben. In der hexagonal dichtesten Kugelpackung liegen die Ebenen der Teilchen so übereinander, dass jeweils die Teilchen der dritten Schicht senkrecht über denen der ersten stehen. In der kubisch dichtesten Packung stehen dagegen die Teilchen der vierten Schicht senkrecht über denen der ersten.
| Legierung | Zusammensetzung | Eigenschaften | Verwendung |
|---|---|---|---|
| Chromnickelstahl | Fe + 0,2% C, 18% Cr, 8% Ni | hart, sehr korrosionsfest | Panzerplatten, Gebrauchsgegenstände |
| Nickelstahl | Fe + Cr, < 20% Ni | sehr zäh, dehnbar | robuster Stahl |
| Messing-Gelbguß | Cu + 30-35% Zink | hart, widerstandsfähig | Maschinenteile |
| Duraluminium | 93,5% Al, 4% Cu, 1% Mg, 1% Si u. Mn | leicht, hart | Flugzeugbau |
Besonders gute Leiter sind die Metalle der ersten Nebengruppe (Kupfer, Silber, Gold). Periodische Tendenzen sind kaum
erkennbar.
Metalle lassen sich gut verformen. Die Bindungsverhältnisse in einem Metall lassen diese Eigenschaften verstehen.
Wenn unter einer Krafteinwirkung die Metallionen in einem Metall aneinandergleiten, bleiben sie ständig im
Elektronengas eingebettet, die Bindungskräfte bleiben erhalten. Metalle stehen damit im Gegensatz zu
Ionenkristallen und zu kovalent gebundenen Gerüststrukturen.
| gediegen | Ru, Os, Rh, Ir, Pd, Pt, Cu, Ag, Au, As, Sb, Bi |
|---|---|
| Oxide | AlOOH, Al2O3, TiO2, FeTiO3, FeCr2O4, FeWo4, MnO2, Fe2O3, Cu2O, ZnO, SnO2, U3O8 |
| Carbonate | MgCO3, CaCO3, SrCO3, ZnCO3 |
| Sulfide | CuFeS2, ZnS, HgS, VS2, MoS2, PbS, SbS3, Bi2S3, FeS |
| Halogenide | NaCl, KCl |
| Sulfate | CaSO4*2H2O, SrSO4, BaSO4, PbSO4 |
| Silicate | Be3Al2Si6O16, Sc2Si2O, ZrSiO4, LiAlSi2O6 |
Silicate sind besonders häufige Mineralien. Die Gewinnung eines Metalls aus einem Silicat ist jedoch sehr aufwendig und kostspielig, nur seltene Elemente, für die es keine anderen Erze in ausreichenden Mengen gibt, werden aus Silicaten gewonnen.
Etliche Metalle kommen als Begleiter von anderen Metallen in Erzen vor und fallen bei der Aufarbeitung als Nebenprodukt an. Cadmium wird z.B. als Nebenprodukt bei der Zinkgewinnung erhalten.
Erze enthalten in der Regel unterschiedliche Mengen von "Gangart", d.h. von unerwünschten Mineralien wie Quarz, Ton, Granit. Die Konzentration des erwünschten Metalls muß groß genug sein, um seine Gewinnung chemisch, verfahrenstechnisch und mit vertretbaren Kosten zu ermöglichen. Erze mit niedriger Konzentration werden nur verarbeitet, wenn dies durch ein einfaches und preisgünstiges Verfahren möglich ist oder wenn das Metall selten und wertvoll ist. Die erforderliche Mindestkonzentration schwankt stark von Metall zu Metall. Ein Aluminium- oder Eisenerz muß mindestens 30% des Metalls enthalten; bei einem Kupfererz können es weniger als 1% sein.
1.Physikalische Trennverfahren nutzen die unterschiedlichen physikalischen Eigenschaften
von Gangart und Mineralien aus.
Das Goldwaschen ist ein Beispiel, bei dem die leichteren Gesteinspartikel von den schwereren Goldpartikeln
getrennt werden. Das zerkleinerte Erz wird in einem Wasserstrom auf einer geneigten Ebene geschüttelt;
das Gold setzt sich ab, während das Gestein vom Wasserstrom mitgerissen wird.
Flotation ist ein Anreicherungsverfahren, das bei vielen Erzen angewandt wird, insbesondere bei
Kupfer-, Zink- und Bleierzen.
Das fein zerriebene Erz wird von einer wasserabstossenden Substanz benetzt die nur vom Mineral adsorbiert wird.
Dadurch bekommt es eine wasserabstossende Hülle. Nur die Gangart wird vom Wasser benetzt. Unter
kräftigem Rühren wird Luft von unten in das Gefäß eingeblasen, wobei ein Schaum entsteht, der die
Mineralpartikel an die Oberfläche trägt, wo sie abgeschöpft werden.
Das Mineral Magnetit, Fe3O4, wird aufgrund seiner magnetischen Eigenschaften von der Gangart abgetrennt. Aus dem zerkleinerten Erz wird das Fe3O4 mit Elektromagneten herausgezogen.
Gediegen vorkommende Metalle wie Kupfer und Bismut können durch Seigern von der Gangart befreit werden. Das Erz wird über den Schmelzpunkt des Metalls erhitzt, das dann abfliesst.
2.chemische Trennverfahren werden aufgrund der unterschiedlichen chemischen Eigenschaften
eines Erzes eingesetzt.
Ein wichtiges Beispiel ist das Bayer-Verfahren (elektrostatisches Trennverfahren) um reines Aluminiumoxid
aus Bauxit-Erz zu erhalten. Bauxit enthält neben Aluminiumhydroxid (Al(OH)3) und Aluminiumoxidhydroxid
(AlOOH), bis zu 30% Fe2O3 und SiO2. Da Aluminiumhydroxid
amphoter (sowohl Säure- als auch Basencharakter) ist, kann es unter Druck mit einer heißen Lösung von
Natriumhydroxid in Lösung gebracht werden. Beim Abkühlen und Verdünnen der Lösung verschiebt sich
das Gleichgewicht auf die Seite des Hydroxid, das ausfällt. Reines Aluminiumoxid wird durch Glühen
des Hydroxid erhalten.
Zur Gewinnung von Magnesium aus Meerwasser (0,13% Mg2+) wird Magnesiumhydroxid durch Zugabe von Calciumhydroxid ausgefällt.
CaO + H2O --> Ca2+ + 2 OH-
Die interessierende Komponente mancher Erze kann durch Laugung herausgetrennt werden. Kupfercarbonat- und Kupferoxiderze mit niedrigem Kupfergehalt können mit Schwefelsäure ausgelaugt werden.
Mit Silber- und Golderzen wird die Cyanidlaugerei durchgeführt, bei der mit einer Natriumcyanidlösung in Anwesenheit von Luft die Metalle als Dicyanokomplex in Lösung gebracht werden.
Nach ihrer Anreicherung werden die meisten Sulfid- und Carbonaterze an Luft geröstet und dadurch in die Oxide umgewandelt. Die Metalle lassen sich in der Regel leichter aus Oxiden als aus Sulfiden oder Carbonaten gewinnen. In manchen Fällen kann das Metall jedoch durch direktes Erhitzen des Sulfids erhalten werden, z.B. As aus FeAsS oder Hg aus HgS.
PbCO3 --> PbO + CO2
CaO + SiO2 --> CaSiO3
Als Reduktionsmittel wird der preiswerteste verfügbare Stoff verwendet, mit dem ein Metall von ausreichender Reinheit gewinnbar ist. Für manche Erze von edleren Metallen, z.B. Quecksilber-, Kupfer- oder Bleisulfid, ist kein Zusatz eines Reduktionsmittels erforderlich. Quecksilber entsteht unmittelbar beim Rösten von Zinnober, HgS. Der Quecksilberdampf wird kondensiert und erfordert keine weitere Reinigung.
Kupfer wird hauptsächlich aus Kupferkies, CuFeS2 (Chalkopyrit), gewonnen. Aus dem Erz durch Flotation angereichertes "Kupferkonzentrat" wird zunächst vorgeröstet, wobei bevorzugt der Eisen-Anteil zum Oxid umgesetzt wird. Das "Verblasen" mit Zuschlägen (Sand, Kalk) im Flammenofen dient dazu, das Eisen in eine Eisensilicatschlacke zu verwandeln, die abfließt. Der verbleibende "Kupferstein" besteht im wesentlichen aus Kupfer(I)-Sulfid, CuS. Das Kupfer wird mit etwa 99% Reinheit durch "Röstreaktionen" erhalten, indem Luft durch den geschmolzenen Kupferstein geblasen wird.
---------------------
2 Cu2S + 3 O2 --> 2 Cu2O + 2 SO2
2 Cu2O + Cu2S --> 6 Cu + SO2
________________________
Cu2S + O2 --> 2 Cu + SO2
Ähnlich erfolgt die Gewinnung von Blei. Ein Teil des Bleisulfids, PbS (Bleiglanz), wird mit Luft zu Bleioxid geröstet. Mit diesem und mit zusätzlichem Bleisulfid wird die Röstreaktion durchgeführt.
PbS + 2 PbO --> 3 Pb + SO2
Kohlenstoff ist ein besonders wichtiges Reduktionsmittel zur Metallgewinnung aus den Oxiden. Zum Beispiel werden Eisen, Cobalt, Nickel, Zink, Cadmium, Zinn, Antimon und Bismut so gewonnen. Die Oxide kommen entweder in den Erzen vor oder werden durch Rösten erhalten.
Bei den Reduktionsprozessen mit Kohlenstoff bei hohen Temperaturen laufen eine Reihe von Reaktionen
ab. Vielfach wird das Metall nicht direkt vom Kohlenstoff, sondern durch Kohlenmonoxid reduziert.
Sowohl das Mineral wie auch Koks sind nicht ohne weiteres schmelzbar, der Kontakt zwischen beiden ist gering,
und die Reaktion läuft langsam ab.
Ein Gas kann sich dagegen gut mit dem Feststoff vermischen. Das Kohlenmonoxid entsteht aus Koks durch
Einblasen von Luft; es wird bei der Reduktion des Metalls zu CO2 oxidiert, das seinerseits wieder vom Koks
zu CO reduziert wird.
Metall-O + CO --> Metall + CO2
CO2 + C --> 2 CO

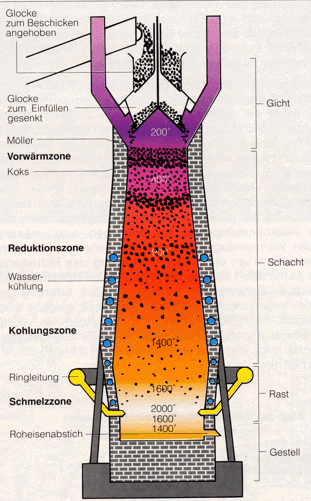
Das aufsteigende Kohlenmonoxid reduziert das Eisenoxid (meist Fe2O3) stufenweise.
In höheren Teilen des Hochofens, wo die Temperatur geringer ist, wird Fe3O4 gebildet ("Reduktionszone"). Das abwärts rutschende
Fe3O4 wird in einer tiefer liegenden, heißeren Zone zu FeO ("Kohlungszone") reduziert. In einer noch tieferen und heißeren
Zone erfolgt die abschließende Reduktion zu Fe ("Schmelzzone").
In den mittleren Zonen zerfällt das CO teilweise zu C und CO2 und fein verteilter Kohlenstoff scheidet sich ab;
dieser bewirkt zu einem kleineren Teil eine direkte Reduktion des Eisenoxids und wird zum Teil im flüssigen
Eisen gelöst.
Fe3O4 + CO --> 3 FeO + CO2
FeO + CO --> Fe + CO2
Das flüssige Eisen sammelt sich am Boden des Hochofens. Die Schlacke, die sich aus dem Kalk und der Gangart gebildet hat, schwimmt flüssig auf dem Eisen und schützt dieses vor Oxidation durch den "Wind". Schlacke und Eisen werden von Zeit zu Zeit "abgestochen". Das oben entweichende "Gichtgas" enthält Kohlenmonoxid und wird als Brennstoff zum Vorheizen des Windes verwendet.
Das Roheisen aus dem Hochofen enthält bis zu 4% Kohlenstoff, 2% Silicium, etwas Phosphor und Spuren von Schwefel. Bei der Stahlherstellung werden diese Bestandteile entfernt oder ihre Konzentration auf gewünschte Werte eingestellt (z.B. Kohlenstoffgehalt); außerdem werden andere Metalle zugesetzt.
| Lithium | Natrium | Kalium | |
|---|---|---|---|
| Entdeckung | 1825 | 1807 | 1807 |
| phy. Eigenschaften | |||
| Härte | zäh | weich | sehr weich |
| Dichte (g/cm3) | 0,53 | 0,97 | 0,86 |
| Smp. | 179 | 97,8 | 63,5 |
| Sdp. | 1340 | 883 | 760 |
| chem. Eigenschaften | |||
| Oxidation | langsam | schnell | sehr schnell |
| Flammenfarbe | karminrot | gelb | violett |
Li, Na und K müssen in Flüssigkeiten aufbewahrt werden, die mit diesen Elementen nicht reagieren. Dazu eignen sich Petroleum und Paraffinoel. Läßt man die drei Metalle an der Luft liegen, so reagieren sie mit Sauerstoff und bilden eine Oxidschicht.
Lithium ist härter als Natrium und Kalium. Alle drei Metalle lassen sich gut mit dem Messer schneiden, es entsteht eine silbrig glänzende Schnittfläche. Der typische Metallglanz verschwindet beim Kalium am schnellsten. Man sagt die Metalle "laufen an". Dabei handelt es sich um eine Oxidation.
Das Wort "alkali" stammt aus dem Arabischen und bedeutet Pflanzenasche. Bestimmte Verbindungen des Kaliums wurden früher aus Pflanzenasche gewonnen.
Alkalimetalle reagieren mit Wasser. Es entsteht Wasserstoff und ein Hydroxid. Diese Hydroxide besitzen eine kennzeichnende Gruppe: die Hydroxidgruppe (OH).
Läßt man festes Natriumhydroxid an der Luft liegen, so zerfließt es nach kurzer Zeit, da es Wasser aus der Luft anzieht. Die Hydroxide aller Alkalimetalle ziehen Wasser an; sie sind hygroskopisch.
Die wässrige Lösung von Natriumhydroxid nennt man Natronlauge (NaOH), die wässrige Lösung des Kaliumhydroxid heißt Kalilauge. Alle Alkalihydroxide lösen sich Wasser und bilden dabei Laugen (Basen).
Auch diese Metalle reagieren mit Wasser, wenn auch weniger heftig als Alkalimetalle.
Calcium, ein Leichtmetall, läßt sich nur schwer mit dem Messer schneiden. Die Schnittfläche ist ebenfalls silberweiß
und metallisch glänzend. An der Luft wird es langsamer oxidiert als die Metalle der ersten Hauptgruppe. Es
wird deswegen in Form von Spänen in gut verschlossenen Flaschen aufbewahrt. Im Laufe der Zeit bildet
sich an der Oberfläche des Metalls eine weiße spröde Oxidschicht.
Wird Calcium verbrannt, brennt es mit roter Flamme und hinterläßt einen weißen spröden Rückstand. Es hat sich Calciumoxid gebildet.
Calciumoxid nennt man auch "gebrannter Kalk", weil man es durch starkes Erhitzen ("Brennen") von
Kalkstein herstellt. Der Name "Ätzkalk" für Calciumoxid weist auf seine alkalischen Eigenschaften hin.
CaO bildet mit Wasser eine Lauge, sie nennt sich Calciumhydroxid (Kalkwasser).
Calciumhydroxid ist ein in Wasser schwer löslicher Stoff. In 1 Liter wasser löst sich etwa 1 g Calciumhydroxid.
Untersuchungen mit Magnesium führen zu ähnlichen Ergebnissen. Das Metall und das Metalloxid reagieren mit Wasser. Es entstehen dabei alkalische Lösungen. Die Reaktionen verlaufen noch langsamer als beim Calcium.