| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Alle chemischen Reaktionen sind im Prinzip elektrischer Natur, da Elektronen an allen Arten von chemischen Bindungen beteiligt sind. Unter Elektrochemie versteht man jedoch in erster Linie die Lehre von Oxidations-Reduktions-Vorgängen.
Mit Hilfe von chemischen Reaktionen kann in galvanischen Zellen elektrische Energie gewonnen werden. Umgekehrt kann bei der Elektrolyse elektrische Energie dazu dienen, chemische Umwandlungen hervorzurufen.
Ein elektrischer Strom ist ein Fluß von elektrischer Ladung. In Metallen sind Elektronen die Träger des elektrischen Stromes; man spricht von metallischen Leitern. In Metallen hält sich eine bewegliche Wolke von Elektronen, das Elektronengas, zwischen den weitgehend fixierten Positionen von positiven Metallionen auf. Werden an einem Ende eines Metalldrahtes Elektronen hineingedrückt, so schieben diese die Elektronen im Draht vor sich her und am anderen Ende des Drahtes treten Elektronen aus. Elektrische Neutralität bleibt gewährt, denn die Zahl der pro Zeiteinheit eintretenden und austretenden Elektronen ist gleich. Der Elektronenfluß hat eine gewisse Ähnlichkeit mit der Strömung einer Flüssigkeit.
Der „Druck“ mit dem die Elektronen in den Draht gezwungen werden, wird elektrische Spannung oder elektrisches Potential genannt; es wird in Volt gemessen. Auch hier kann der Gedanke behilflich sein, es handele sich um eine Flüssigkeit die mit einem gewissen Druck durch eine Leitung strömt oder die einen bestimmten Druck auf einen Behälter ausübt.
Die Einheit für die elektrische Ladung (Ladungsmenge, Elektrizitätsmenge) ist das Coulomb. (» Schlauchstärke ® Menge der Flüssigkeit)
Die Stromstärke wird in Ampere gemessen; ein Ampere entspricht dem Fluß von 1 Coulomb pro Sekunde.
Nach unserem Vergleichsbild, die Menge Flüssigkeit die pro Zeiteinheit durch einen Schlauch bestimmter Stärke fließt.
Metalle setzen dem Stromfluß einen Widerstand entgegen , der wahrscheinlich mit den Schwingungen der Metallionen um ihre Gitterpunkte zusammenhängt; die schwingenden Ionen behindern die Elektronen in ihrer Bewegung. Bei steigender Temperatur nimmt die Schwingung zu und mit ihr der elektrische Widerstand. Der Widerstand wird in Ohm (W) gemessen.
Beim elektrischen Stromfluß durch Elektrolyte wird die Ladung durch Ionen getragen. Der Strom kann nur fließen, wenn sich die Ionen bewegen können. Die elektrolytische Leitung erfolgt deshalb in erster Linie in Lösungen von Elektrolyten oder in geschmolzenen Salzen. Dabei treten stets chemische Veränderungen der beteiligten Ionen auf.
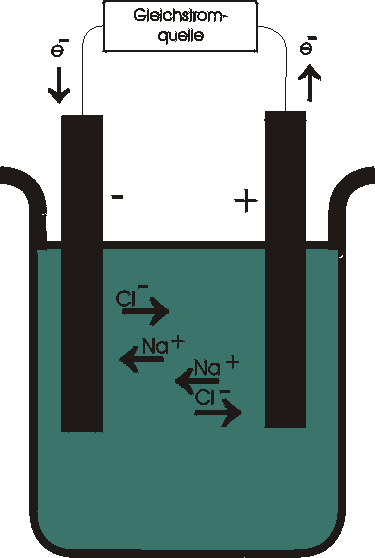
Betrachten wir die Vorgänge am Beispiel des Stromflusses durch eine Schmelze von NaCl. In die Schmelze tauchen zwei inerte Elektroden. Eine Spannungsquelle drückt Elektronen in die linke Elektrode, die deshalb als negativ geladen angesehen werden kann und Kathode genannt wird.
Aus der rechten positiven Elektrode, der Anode, werden Elektronen abgezogen.
Im elektrischen Feld zwischen den Elektroden werden die
positiven Na+-Ionen
(Kationen) von der negativ geladenen Kathode angezogen und die negativen Cl--Ionen (Anionen) werden von
der positiv geladenen Anode angezogen. Bei der elek-trolytischen Leitung
bewegen sich die Ionen in zwei entgegen gesetzte Richtungen; die Kationen wandern zur Kathode und die
Anionen wandern zur Anode.

Kathode: Anode:
Na+ + e- ® Na 2Cl- ® Cl2 + 2e-
Damit der Ladungstransport über die Grenzflächen zwischen Kathode und Elektrolyt erfolgen kann, muß eine chemische Spezies im Elektrolyten Elektronen aus der Kathode übernehmen und somit reduziert werden. An der Anode muß eine Spezies Elektronen abgeben und somit oxidiert werden. In unserem Beispiel nehmen die Na+-Ionen, die an der Kathode ankommen, Elektronen auf und werden zu Na reduziert. Chloridionen werden an der Anode zu Chloratomen oxidiert; die Chloratome vereinigen sich dann zu Cl2-Molekülen. Der Gesamtvorgang wird Elektrolyse genannt.
Der Fluß der negativen Ladungen ist folgender. Elektronen werden von der Spannungsquelle in die Kathode gepumpt, wo sie von Na+-Ionen übernommen werden, die von dieser Elektrode angezogen werden. Cl--Ionen bewegen sich zur Anode und geben dort Elektronen ab, die von der Spannungsquelle abgezogen werden. Da die Na+-Ionen zu Na-Metall und die Cl--Ionen zu Chlorgas umgesetzt werden, kann der Vorgang nur so lange anhalten, bis der Vorrat an Na+- und Cl--Ionen erschöpft ist, d.h. bis alles Natriumchlorid in seine Elemente zerlegt worden ist.
Die elektrolytische Leitung hängt von der Beweglichkeit der Ionen ab. Faktoren, welche die Beweglichkeit behindern, verursachen eine Erhöhung des elektrischen Widerstandes. Zu diesen Faktoren gehören interionische Anziehungskräfte, Solvation von Ionen und die Viskosität der Flüssigkeit. Da eine Temperaturerhöhung diesen Faktoren entgegenwirkt, nimmt der Widerstand mit steigender Temperatur ab (im Gegensatz zu Metallen).
Die Elektrolytflüssigkeit bleibt jederzeit elektrisch neutral. Die gesamte positive Ladung der Kationen ist stets gleich groß wie die gesamte negative Ladung der Anionen.
|
|
Kathode - |
Anode + |
|
angezogene Ionen |
Kationen |
Anionen |
|
Richtung des
Elektronenflusses |
in die Zelle |
aus der Zelle |
|
Halbreaktion |
Reduktion |
Oxidation |
|
Pole: |
|
|
|
bei Elektrolyse |
- !!! |
+ !!! |
|
bei galvanischer
Zelle |
+ !!! |
- !!! |
Konventionen zu Elektrodenprozessen
Durch Elektrolyse von geschmolzenem Natriumchlorid werden metallisches Natrium und Chlorgas technisch hergestellt. Auf die gleiche Art werden andere reaktionsfähige Metalle wie Kalium und Calcium hergestellt. Diese Metalle kann man nicht durch Elektrolyse von Salzen in wässriger Lösung erhalten, weil Wasser an den Elektroden- prozessen beteiligt ist.
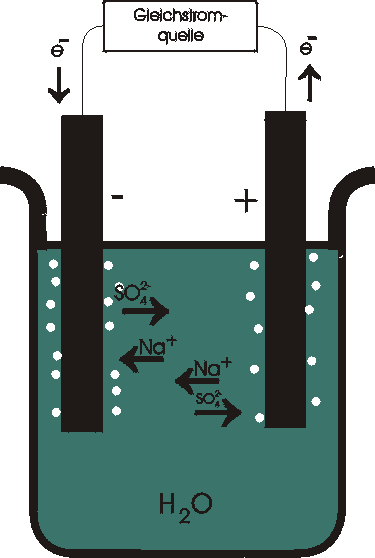
Bei der Elektrolyse einer wässrigen Lösung von Natriumsulfat wandern die Na+-Ionen zur Kathode und die SO42--Ionen zur Anode. In sehr geringer Konzentration sind in der Lösung außerdem H+- und OH--Ionen aus der Eigendissoziation des Wassers vorhanden. Trotz ihrer geringen Konzentration lassen sich diese Ionen leichter entladen. An der Kathode werden nicht die Na+-Ionen, sondern die H+-Ionen entladen; es scheidet sich Wasserstoffgas ab. Die H+-Ionen werden durch weitere Dissoziation von Wasser im Bereich der Kathode nachgeliefert, wobei außerdem OH--Ionen entstehen, die dann in Richtung Anode wandern.
Elektrolyse einer Na2SO4-Lösung:
Kathodenprozeß:
H2O « H+ + OH- 2*
2H+ +2e- ® H2
________________________
2H2O +
2e- ® H2
+ 2OH-
Auch an der Anode werden nicht die SO42--Ionen oxidiert. Vielmehr werden die OH--Ionen des Wassers oxidiert, wobei Sauerstoff entsteht. Durch weitere Dissoziation des Wassers im Bereich der Anode werden OH--Ionen nachgeliefert, wobei außerdem H+-Ionen entstehen, die in Richtung Kathode wandern. Insgesamt wird nur Wasser in seine Elemente zerlegt, in Wasserstoff, der sich an der Kathode abscheidet und Sauerstoff, der sich an der Anode abscheidet.
Anodenprozeß:
H2O « H+ + OH- 2*
2OH- ® ½O2 + H2O + 2e-
__________________________
H2O ® ½O2 + 2H+
+2e-
Gesamtreaktion an Kathode und Anode:
Kathode 2H2O + 2e- ® H2 + 2OH-
Anode H2O ® ½O2 + 2H+
+2e-
____________________________________
H2O ® H2 + ½O2
Kathode Anode
2H2O + 2e-®H2 + 2OH H2O ® ½O2 + 2H+ +2e
Bei der Elektrolyse einer wässrigen Lösung von NaCl wird das Anion des Elektrolyten entladen, das Kation jedoch nicht. An der Kathode werden H+-Ionen entladen, Wasserstoff wird abgeschieden und außerdem bilden sich OH--Ionen. An der Anode werden die Cl--Ionen entladen und Chlorgas scheidet sich ab. Die Na+-Ionen bleiben unverändert in der Lösung. In dem Maß, wie die Cl--Ionen aus der Lösung entfernt werden, bilden sich die OH--Ionen und am Schluß enthält die Lösung nur noch Na+- und OH--Ionen. Durch Eindampfen der Lösung wird festes Natriumhydroxid erhalten. Der Prozeß dient zur technischen Herstellung von Wasserstoff, Chlor und Natriumhydroxid („feste Natronlauge“).
Elektrolyse einer
NaCl-Lösung:
Kathodenprozeß
H2O « H+ + OH- 2*
2H+ +2e- ® H2
________________________
2H2O +
2e- ® H2
+ 2OH-
Anodenprozeß
2Cl- ® Cl2 + 2e-
Gesamtreaktion
2H2O + 2Na+ + 2Cl- ® H2 + Cl2 + 2Na+ + OH-
Bei der Elektrolyse einer wässrigen Kupfersulfatlösung zwischen inerten Elektroden erfolgt der Ladungstransport in der Lösung durch Cu2+- und SO42--Ionen, von denen jedoch nur die Kationen entladen werden. Der Anodenprozeß ist der gleiche wie bei der Natriumsulfatlösung. Bei der Elektrolyse einer Kupferchloridlösung werden sowohl die Kationen wie die Anionen des Kupferchlorids entladen. Es wird Kupfermetall und Chlorgas abgeschieden.
Elektrolyse einer
CuSO4-Lösung:
Anode H2O ® ½O2 + 2H+
+2e-
Kathode 2e-
+ Cu2+ ® Cu
____________________________________
Cu2+ + H2O ® Cu + ½O2 + 2H+
Eine Zelle, die als elektrische Stromquelle dient, wird galvanische Zelle oder voltaische Zelle oder galvanisches Element genannt. Luigi Galvani (1780) und Alessandro Volta (1800) waren die ersten, die mit der Umwandlung von chemische in elektrische Energie experimentiert haben.
Die Reaktion von Zinkmetall mit Kupfer(II)-Ionen in wässriger Lösung ist ein Beispiel für eine spontane Reaktion, bei der Elektronen übertragen werden. Man kann sich die Reaktion nicht nur in zwei Halbreaktionen zerlegt denken, sondern man kann die Halbreaktionen räumlich getrennt an den Elektroden einer galvanischen Zelle ablaufen lassen.
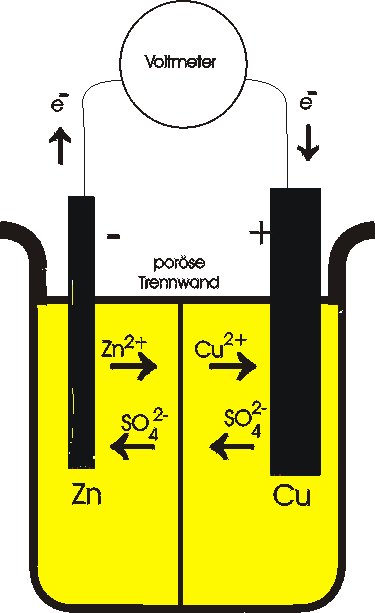
Anode: Zn ® Zn2+ + 2e- Kathode: Cu2+ + 2e- ® Cu
Bei der gezeigten Versuchsanordnung wird diese Reaktion ausgenutzt, um einen elektrischen Strom zu erzeugen. Die Halbzelle auf der linken Seite besteht aus einer Zinkelektrode, die in eine ZnSO4-Lösung taucht. Die rechte Halbzelle besteht aus einer Kupferelektrode in einer CuSO4-Lösung. Die beiden Halbzellen sind durch eine poröse Wand getrennt, die eine Vermischung der Lösungen verhindert, aber den Durchtritt von Ionen gestattet. Diese spezielle galvanische Zelle wird auch Daniell-Zelle oder Daniell-Element genannt.
Wenn die beiden Elektroden über einen Draht elektrisch leitend miteinander verbunden werden, fließen Elektronen von der Zinkelektrode zur Kupferelektrode. An der Zinkelektrode wird Zinkmetall zu Zink-Ionen oxidiert. Die dabei entstehenden Elektronen verlassen die Galvanische Zelle durch diese Elektrode, die deshalb auch Minuspol oder Anode genannt wird (an der Anode findet immer die Oxidation statt). Die Elektronen fließen durch den Draht zur Kupferelektrode, wo sie die Reduktion von Kupfer(II)-Ionen zu Kupfermetall bewirken. Kupfer scheidet sich auf dieser Elektrode ab, die Elektronen fließen durch sie in die galvanische Zelle ein, sie wird Pluspol oder Kathode genannt.
Außerhalb der Zelle fließen die Elektronen vom Minus- zum Plus-Pol. Innerhalb der Zelle erfolgt der Stromfluß durch Ionenbewegungen, und zwar müssen die Anionen (SO42-) von der Kathode zur Anode und die Kationen in umgekehrter Richtung wandern. Von der Anode werden Zn2+-Ionen an die Lösung abgegeben. Elektronen bleiben im Metall zurück. Zum Ausgleich der zusätzlichen positiven Ladungen im Bereich um die Anode müssen SO42--Ionen in Richtung Anode wandern, gleichzeitig wandern die Zn2+-Ionen in Richtung Kathode. An der Kathode werden Cu2+-Ionen aus der Lösung entfernt, indem sie Elektronen aus der Elektrode aufnehmen und sich so als Kupfer an der Kathode abscheiden. Cu2+-Ionen aus der Lösung bewegen sich in Richtung Kathode und ersetzen die verbrauchten Cu2+-Ionen.
Halbreaktionen
Zn ® Zn2+ + 2e-
2e-
+ Cu2+ ® Cu
_____________________
Gesamtreaktion
Zn + Cu2+ ® Zn2+ + Cu
Die poröse Trennwand verhindert die mechanische Vermischung der Lösungen. Wenn die Cu2+-Ionen in Kontakt mit der Zn-Elektrode kämen, würde es zur direkten Übertragung von Elektronen kommen und kein Strom würde durch den äußeren Draht fließen.
home / Chemie-Ecke