| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
In einem Molekül werden die Atome durch kovalente Bindungen zusammengehalten. Eine kovalente Einfachbindung besteht aus einem Paar von Elektronen, das zwei Atomen gemeinsam angehört.

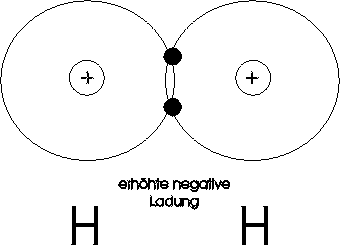
Symbolisch schreiben wir für ein Wasserstoffmolekül H : H oder H - H. In der ersten
Schreibweise symbolisieren die beiden Punkte das gemeinsame Elektronenpaar;
gebräuchlicher ist die zweite Schreibweise, in welcher der Bindungsstrich für das
gemeinsame Elektronenpaar steht.
Obwohl die Elektronen dem Molekül als ganzes angehören, ist jedes
Wasserstoffatom an zwei Elektronen beteiligt und hat damit eine
Elektronenkonfiguration, die derjenigen des Edelgases Helium entspricht.
Die Theorie von Lewis betont das erreichen der Edelgaskonfiguration als Ziel für jedes Atom.
Für Wasserstoff ist das die Zwei-Elektronenkonfiguration des Heliums; für andere Elemente ist es das Oktett, d.h. die Acht-Elektronenkonfiguration der übrigen Edelgase (Oktettregel).
Ein Halogenatom (Element der siebten Hauptgruppe) hat sieben Valenzelektronen. Durch Bildung einer kovalenten Bindung zwischen den beiden Atomen kommt jedes Atom zu einem Elektronen-Oktett.
![]()
Die beiden Fluoratome haben nun ein gemeinsames Elektronenpaar.
Zusammen mit den übrigen Elektronenpaaren ist jedes Fluoratom von acht
Elektronen umgeben: dem bindenden (gemeinsamen) Elektronenpaar und sechs
Elektronen, die jedes Atom für sich alleine hat.
Valenzelektronenpaare, die ein Atom für sich alleine hat, werden nichtbindende
Elektronenpaare, freie Elektronenpaare oder einsame Elektronenpaare genannt.
Die Zahl der kovalente Bindungen, an denen ein Atom in einem Molekül beteiligt ist, ergibt sich oft aus der Zahl der Elektronen, die noch fehlen, um die Konfiguration des nächsten Edelgases zu erreichen. Da bei den Nichtmetallen die Zahl der Valenzelektronen gleich der Hauptgruppennummer (N) ist, werden zum erreichen des Elektronen-Oktetts 8 - N Elektronen benötigt. Durch je eine kovalente Bindung kommt ein Atom zu je einem weiteren Elektron.
Zwei Atome können über mehr als ein gemeinsames Elektronenpaar verfügen. Man spricht dann von einer Mehrfachbindung. Bei einer Doppelbindung sind zwei, bei einer Dreifachbindung sind drei gemeinsame Elektronenpaare vorhanden.
Die meisten Verbindungen besitzen weder das eine noch das andere Extrem. Eine rein kovalente Bindung gibt es nur zwischen Atomen des gleichen Elements (H-H, Cl-Cl, O-O, etc.). Wenn zwei unterschiedliche Atome kovalent miteinander verknüpft sind, ist die Elektronenladung nicht gleichmäßig zwischen den beiden Atomkernen verteilt; die beiden Atome teilen sich das gemeinsame Elektronenpaar nicht gleichmäßig, ein Atom wird die Elektronen immer etwas stärker zu sich ziehen als das andere. Dieses beruht auf der unterschiedlichen Elektronegativität der verschiedenen Atome.
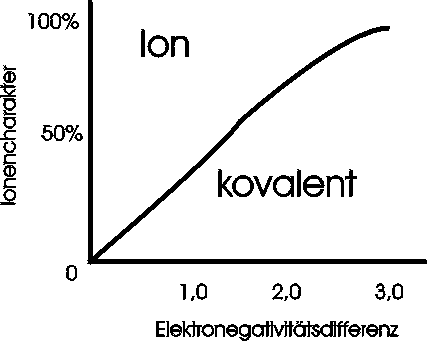
Die Elektronegativitätsdifferenzen zwischen Nichtmetallen sind meist gering. Die Bindungen sind überwiegend kovalent. Bei größeren Differenzen (unter 1,7) der Elektronegativitäten wird eine Bindung „polar", d.h. ihre Ladungswolke verteilt sich nicht mehr gleichmäßig um die Atome herum, sondern verschiebt sich hin zu dem Atom mit der höheren Elektronegativität. Hierdurch können partielle Teilladungen an Molekülen entstehen.
Die Formalladung wird berechnet, indem man die Bindungselektronen zu gleichen Teilen zwischen den gebundenen Atomen aufteilt, d.h. für jede kovalente Bindung erhält eines der beteiligten Atome ein Elektron. Die Zahl der Elektronen, die jedes Atom nach der Aufteilung besitzt, wird mit der Zahl der Valenzelektronen verglichen, die es als neutrales Atom haben würde. Hat es ein oder mehr Elektronen zuviel bekommt es eine negative Formalladung, je nach Anzahl der überzähligen Elektronen. Hat es Elektronen zuwenig bekommt es dementsprechende positive Formalladungen.
Def. aus dem Schüler-Duden Chemie:
Die Elektronen eines Atoms besetzen Orbitale. In jedes Orbital
passen zwei Elektronen. Die Anzahl der besetzten Orbitale
bleibt auch erhalten, wenn sich das Atom an kovalenten
Bindungen beteiligt. Bei Elementen der zweiten Periode stehen
nur vier Orbitale in der Valenzschale zur Verfügung (4*2= 8
Elektronen, ein 2s- und drei 2p-Orbitale). Atome dieser
Elemente können maximal vier kovalente Bindungen eingehen; das
Elektronenoktett wird bei ihnen nie überschritten.
Bei Elementen der dritten und höherer Perioden ist das anders,
da die Zahl der verfügbaren Orbitale in der Valenzschale größer
ist (d-Orbitale zusätzlich zu den s- und p-Orbitalen). Ihre
Atome können sich an mehr als vier kovalenten Bindungen
beteiligen, wobei mehr als sechs Bindungen allerdings selten
vorkommen.