| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Zur 6.Hauptgruppe gehören die Elemente Sauerstoff, Schwefel, Selen, Tellur und Polonium. Sie werden auch Chalkogene (gr.:„Erzbildner") genannt. Sauerstoff unterscheidet sich in seinen Eigenschaften deutlich von den übrigen Elementen dieser Gruppe. Polonium ist ein Produkt des radioaktiven Zerfalls von Radium. Wegen seiner Instabilität hat es keine Bedeutung und seine Eigenschaften sind wenig erforscht.
Einige Eigenschaften der Elemente sind in der Tabelle zusammengefaßt.
| Sauerstoff | Schwefel | Selen | Tellur | |
|---|---|---|---|---|
| Farbe | farblos | gelb | rot / grau | grau |
| Schmelzpunkt °C | -218,4 | 119 | 217 | 450 |
| Siedepunkt °C | -182,9 | 444,6 | 688 | 950 |
| Elektronegativität | 3,4 | 2,6 | 2,6 | 2,1 |
| Molekülformel | O2 | S8-Ring | Se8-Ring oder Sex-Kette | Tex-Kette |
Jedes Chalkogen ist ein weniger reaktives Nichtmetall als das Halogen der gleichen Periode. Die Elektronegativitäten nehmen mit zunehmender Ordnungszahl ab. Sauerstoff ist nach Fluor das elektronegativste Element.
Chemisch verhalten sich die Chalkogene überwiegend wie Nichtmetalle. Bei den schwereren Elementen zeigen sich jedoch gewisse metallische Eigenschaften. Polonium ist als Metall anzusehen. Tellur verhält sich ähnlich wie ein Metall, seine Verbindungen entsprechen aber mehr denen eines Nichtmetalls. Schwefel, Selen, Tellur und Sauerstoff zählen eindeutiger zu den Nichtmetallen.
Luft ist ein Gasgemisch. Seine Zusammensetzung hängt von der Höhenlage und, in geringerem Maße, von der Ortslage ab.
| Volumen-% | |
|---|---|
| N2 | 78,08 |
| O2 | 20,95 |
| Ar | 0,933 |
| CO2 | 0,034 |
| Ne | 0,0018 |
| He | 5*10-4 |
| CH4 | 2*10-4 |
| Kr | 1*10-4 |
| N2O | 5*10-5 |
| H2 | 5*10-5 |
| CO | 1*10-5 |
| Xe | 8*10-6 |
| O3 | 1*10-6 |
| NH3 | 1*10-6 |
| NO2 | 1*10-7 |
| SO2 | 2*10-8 |
| H2S | 2*10-8 |
Alle Metalle, mit Ausnahme einiger Edelmetalle, reagieren mit Sauerstoff. Von allen
Metallen sind Oxide bekannt, einige müssen jedoch auf Umwegen hergestellt
werden.
Ausgenommen Barium, mit dem sich das Peroxid BaO2 bildet, führt die Reaktion
aller übrigen Metalle mit Sauerstoff zur Bildung von normalen Oxiden. Die Reaktion
mit Quecksilber ist reversibel.
Bei Metallen, die in mehreren Oxidationsstufen auftreten können, hängt die Zusammensetzung des gebildeten Oxides im allgemeinen von der Menge des Sauerstoffs und des Metalls und von den Reaktionsbedingungen ab. So reagiert Eisen (Fe) mit Sauerstoff bei niedrigem Sauerstoffangebot und Temperaturen über 600°C unter Bildung von FeO; fein verteiltes Eisen, das an Luft erhitzt wird, bildet bei 500°C Fe3O4 und bei Temperaturen über 500°C Fe2O3. Rost ist hydratisiertes Fe2O3.
Mit Ausnahme der Edelgase und der Halogene reagieren alle Nichtmetalle mit Sauerstoff. Oxide der Halogene und der schweren Edelgase sind allerdings über Umwegen zu erhalten. Bei der Reaktion von Phosphor und Kohlenstoff mit Sauerstoff hängt die Zusammensetzung der Produkte von der Menge des angebotenen Sauerstoffes ab. Bei begrenzter Sauerstoffzufuhr bilden sich die Oxide mit niedrigerer Oxidationszahl, P4O6 bzw. CO, bei reichlichem Sauerstoffangebot wird die höchstmögliche Oxidationszahl erreicht, P4O10 bzw. CO2. Bei der Verbrennung von Schwefel entsteht Schwefeldioxid, SO2; dieses kann in Anwesenheit eines Katalysators zu Schwefeltrioxid, SO3, weiter verarbeitet werden.
Die Reaktion von Stickstoff mit Sauerstoff ist eine der wenigen Verbrennungs- reaktionen, die endotherm ist. Sie läuft nur bei hohen Temperaturen in begrenztem Maße ab. Das gebildete Stickstoffoxid, NO, reagiert aber bei Raumtemperatur mit Sauerstoff spontan zu NO2 weiter.
Wasserstoff verbindet sich mit Sauerstoff in stark exothermer Reaktion zu Wasserdampf. Auf indirektem Wege können die Elemente zu einer weiteren Verbindung, dem Wasserstoffperoxid H2O2, vereint werden. Wasserstoffperoxid ist eine farblose Flüssigkeit, die bei 150,2°C siedet und bei -0,4°C gefriert. Beim Erhitzen von reinem H2O2 kann die Zersetzung explosionsartig erfolgen, weshalb H2O2 nur als wässrige Lösung im Handel ist (30-35%ig). Bei Raumtemperatur ist die Zerfallsgeschwindigkeit sehr gering. Wasserstoffperoxid wird häufig als Oxidationsmittel eingesetzt, es hinterläßt keine belastenden Abfallstoffe.
1.) Stahlgewinnung
2.) Herstellung von bestimmten Metallen
3.) Herstellung bestimmter Sauerstoffverbindungen
4.) Raketentreibstoff; zusammen mit Wasserstoff
5.) Zum Schweißen
6.) Behandlung von Abwässern
7.) Atmungsgas

Ozon ist ein blaßblaues, giftiges Gas mit einem charakteristischen, stechenden Geruch. Zur Herstellung von Ozon erzeugt man in einem O2-Gasstrom eine elektrische Entladung. Durch die Stromzufuhr werden die O2-Moleküle gespalten und verbinden sich darauf mit einem neuen O2-Molekül zu O3. FCKWs können über Radikalbildung und UV-Einwirkung diesen Prozeß umkehren (Schädigung der Ozonschicht). In hohen Konzentrationen wirkt Ozon gesundheitsschädlich, diese Konzentrationen werden in Anwesenheit von Stickstoffdioxid und UV-Licht schnell erreicht (Sommersmog).
1. Kohlenmonoxid. Es entsteht bei der unvollständigen Verbrennung von Kohle oder Kohlenwasserstoffen. Autos sind die Hauptquelle dieses Schadstoffes. Kohlenmonoxid ist giftig, weil es sich mit dem Hämoglobin des Blutes verbindet und dadurch den Sauerstofftransport durch das Blut unterbindet. Sonst ist CO jedoch nicht sehr reaktionsfähig. Durch allmähliche Reaktion mit O2 aus der Luft bildet sich CO2, so daß CO aus der Atmosphäre verschwindet.
2. Schwefeldioxid entsteht bei der Verbrennung von Kohle und Erdölprodukten sowie bei der Aufarbeitung sulfidischer Erze. Die Hauptquelle ist die Verbrennung in Kohlekraftwerken und zu Heizzwecken. Kohle enthält meist zwischen 0,5 und 3% (manchmal bis zu 8%) Schwefel. Daneben gelangen auch große Mengen von SO2 aus natürlichen Quellen, vor allem durch Vulkane, in die Atmosphäre.
Mit Wasser bildet SO2 schweflige Säure und im Beisein von Luftfeuchtigkeit wird SO2 durch den Luftsauerstoff allmählich zu Schwefelsäure oxidiert. Diese Säuren sind der Hauptbestandteil des „sauren Regens".
3. Stickstoffmonoxid, NO, entsteht durch Reaktion von N2 mit O2 bei hohen Temperaturen. Bei 2000°C ist die NO-Ausbeute etwa 1% bei 2500°C etwa 2%. Bei tieferen Temperaturen setzt sich NO mit O2 zu Stickstoffdioxid, NO2, um. Bei den Temperaturen in einem Auto entsteht immer etwas NO aus dem Stickstoff und Sauerstoff der Verbrennungsluft; das durch menschliche Aktivitäten erzeugte NO und NO2 stammt zum großen Teil hieraus. Stickstoffoxide entstehen in erheblichen Mengen auch auf natürlichem Wege, insbesondere bei Gewittern.
NO und NO2 sind normalerweise in kleinen Konzentrationen in der Luft vorhanden und nehmen am Stickstoffkreislauf teil. NO2 ist erheblich giftiger als NO. Im allgemeinen sind ihre Konzentrationen jedoch so gering, das keine direkten ernsthaften Effekte resultieren. Wenn sie mit dem Regenwasser ins Erdreich gelangen, können Nitrate entstehen, die durch ihre düngende Wirkung sogar vorteilhafte Wirkungen zeigen können. Die Bedeutung der Stickstoffoxide als umweltbelastende Stoffe liegt in ihrer Funktion bei der Bildung anderer, ernsterer Schadstoffe.
4. Kohlenwasserstoffe sind Verbindungen, die Kohlenstoff und Wasserstoff
enthalten. Sie sind Bestandteile im Erdöl, im Erdgas und in der Kohle. Sie gelangen
bei der Erdölaufarbeitung, durch Verdampfen aus Vorrats- und Transportbehältern
und durch unvollständige Verbrennung in die Atmosphäre. Unverbrannte
Kohlenwasserstoffe in Autoabgasen liefern einen wesentlichen Beitrag. Bestimmte
Kohlenwasserstoffe werden auch durch natürliche Prozesse an die Atmosphäre
abgegeben; dazu gehören vor allem Methan, CH4, das bei Fäulnissprozessen
entsteht.
Manche Kohlenwasserstoffe wirken krebserregend. Die Hauptgefahr der
atmosphärischen Kohlenwasserstoffbelastung liegt jedoch in Schadstoffen, die sich
in der Luft aus den Kohlenwasserstoffen bilden. Stickstoffdioxid zersetzt sich im
Sonnenlicht unter Bildung von O-Atomen, die ihrerseits mit O2 zu Ozon (O3)
reagieren. Ozon ist sehr reaktionsfähig und reagiert mit manchen
Kohlenwasserstoffen unter Bildung von sauerstoffhaltigen organischen
Verbindungen. Da dieser Prozess durch Sonnenlicht eingeleitet wird, spricht man
von photochemisch induzierter Luftverschmutzung. Zu den gebildeten Verbindungen
gehören solche, die erhebliche Reizungen der Augen, der Haut und der
Atmungsorgane verursachen. Sie machen den sogenannten photochemischen Smog
aus.
5. Halogenkohlenwasserstoffe enthalten Halogenatome, die an Kohlenstoffatome gebunden sind. Sie werden als Lösungsmittel benutzt und dienten als Treibmittel in Sprühdosen, als Kühlmittel in Kühlaggregaten und zur Reinigung von Computerchips. Durch Verdampfung gelangen sie in die Atmosphäre. Durch Sonnenlicht werden sie zersetzt, wobei aggressive Zwischenprodukte entstehen, welche die Vegetation schädigen können. Aufgrund ihrer Beeinflußung des O2/O3- Gleichgewichtes in der Stratosphäre, wodurch es zu einer Abnahme der, vor dem UV-Licht der Sonne, schützenden Ozonschicht kommt („Ozonloch").
6. Schwebstoffe sind fein verteilte Flüssigkeitstropfen oder Feststoffe (d = 0,01 bis
100 µm). Sie entstehen hauptsächlichals Rauch bei der Verbrennung von Kohle und
anderen organischen Substanzen. Weitere Quellen sind bestimmte
Industrieprozesse, wie die Herstellung von Zement.
Schwebstoffe können Lungenschäden verursachen („Asbest") und können giftig
sein. Krebserregende Stoffe können in Rußteilchen enthalten sein.
Schwefel kann in der alpha- oder in der beta-Struktur vorliegen. Er ist unlöslich in Wasser, aber in manchen organischen Lösungsmitteln.
8-Molekülen aufgebaut sind. Acht Schwefel-Atome sind durch kovalente Einfachbindung zu einem gewellten Ring verknüpft. Erwärmt man alpa-Schwefel über 95,6 °C wandelt er sich reversibel in beta-Schwefel um. Dieser besteht auch aus S8-Molekülen, sie sind im Kristall allerdings anders gepackt. Das Auftreten verschiedener kristalliner Formen desselben Stoffes nennt man Polymorphie.
beta-Schwefel schmilzt bei 119,6 °C. Flüßiger Schwefel besteht bis etwa 200 °C überwiegend aus S8-Ringen aber schon jetzt nehmen auch andere Formen Gestalt an (S6, S7, S8, S9, ...). Bei 444,6 °C siedet Schwefel. Der Dampf besteht aus S8 - S2 Ketten- oder Ringmolekülen.
Selen besteht unter Normalbedingungen aus spiralförmigen, langen Ketten von Selen-Atomen, die im Kristall parallel gebündelt sind. Es existieren auch Modifikationen aus ringförmigen Se8-Molekülen. Selen ist ein schlechter elektrischer Leiter (Halbleiter), die Leitfähigkeit nimmt aber unter Lichteinfluß etwa tausendfach zu.
Telur besteht ebenfalls aus spiralförmigen langen Kettenmolekülen aber es sind keine Modifikation aus Te8-Molekülen bekannt.
Polonium bildet bei Raumtemperatur ein kubisches Kristallgitter. Zwei Modifikationen sind bekannt.
Vorkommen von Schwefel, Selen und Telur
| Häufigkeit % | Vorkommen | |
|---|---|---|
| Schwefel | 0,05 | elementar, in zahlreichen Sulfiden, z.B. FeS2 (Pyrit), PbS (Bleiglanz), ZnS (Zinkblende, Spahlerit), CuFeS2 (Kupferkies, Chalkopyrit). In Sulfaten, CaSO4*2H2O (Gips) und CaSO4 (Anhydrit), MgSO4*7H2O (Bittersalz), BaSO4 (Schwerspat). In Kohle als FeS und organischen Verbindungen. Im Erdöl als org. Verbindung und im Gas als H2S. Proteine als Cys u. Met. |
| Selen | 9*10-6 | In Sulfiden, in kleiner Menge als Selenide. In seltenen Mineralien: PbSe, Cu2Se, Ag2Se. |
| Tellur | 2*10-7 | In Sulfiden spurenweise in Form von Telluriden. In seltenen Mineralien: PbTe, Cu2Te, Ag2Te, Au2Te, AuTe2. |
Von Bedeutung ist die Gewinnung von Schwefel aus Schwefelwasserstoff, der bei der Verkokung von Kohle im Kokereigas und bei der Entschwefelung von Erdöl anfällt und der auch im Erdgas und im „Wassergas" enthalten ist. Bei diesem Prozeß wird ein Teil des Schwefelwasserstoffes zu Schwefeldioxid verbrannt, Das dann mit weiterem H2S an einem Katalysator (AlOOH) umgesetzt wird.
Die wichtigste Quelle für Selen und Tellur ist der Anodenschlamm, der bei der elektrolytischen Raffination von Kupfer anfällt.
Schwefelwasserstoff ist brennbar; je nach Menge des angebotenen Sauerstoffs entsteht entweder Schwefel oder Schwefeldioxid neben Wasserdampf. In sauren Lösungen können bestimmte Ionen mit H2S ausgefällt werden.
Pb2+ + H2S <--> PbS + 2H+
H2S, H2Se und H2Te sind in Wasser mäßig gut löslich. Sie sind schwache Säuren in der wässrigen Lösung.
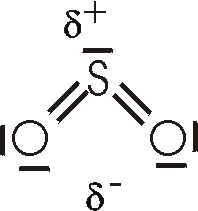
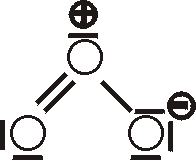
Aufgrund der unterschiedlichen Elektronegativität von S und O und der gewinkelten
Molekülstruktur ist das Molekül polar. Dementsprechend läßt sich SO2 relativ leicht
verflüssigen (--> H2O); bei Normaldruck liegt der Siedepunkt bei -10°C und bei 20°C
reicht ein Druck von etwa 300 kPa, um das Gas zu verflüssigen. Flüssiges SO2 ist
ein gutes Lösungsmittel für viele Stoffe.
Schwefeldioxid ist in Wasser mäßig gut löslich. Die Lösung enthält eine kleine
Konzentration von Schwefeliger Säure, H2SO3. Die reine Verbindung H2SO3 ist
instabil und kann nicht isoliert werden. Schwefelige Säure ist eine mittelstarke,
zweiprotonige Säure.
Selendioxid und Tellurdioxid werden bei der Reaktion der Elemente mit Sauerstoff
erhalten. Sowohl SeO2 wie TeO2 sind weiße Feststoffe.
Selenige Säure, H2SeO3, entsteht wenn das gut lösliche SeO2 in Wasser gelöst wird.
Sie ist eine zweiprotonige Säure, die etwas schwächer als Schweflige Säure ist.
Durch Eindampfen der Lösung kann die reine Verbindung erhalten werden.
Tellurdioxid ist nur wenig löslich in Wasser und reine H2TeO3 ist unbekannt. In
alkalischen Lösungen lösen sich SeO2 und TeO2 unter Bildung von Seleniten bzw.
Telluriten.
Selen- und Tellurverbindungen der Oxidationszahl +IV sind stärkere Oxidationsmittel
und schlechtere Reduktionsmittel als die entsprechenden Schwefelverbindungen.
SeO2 wird bei bestimmten Synthesereaktionen als Oxidationsmittel eingesetzt.
Schwefeltrioxid ist eine flüchtige Verbindung (Sdp.: 44,8°C, Smp.: 16,9°C). Im Dampfzustand und im flüssigen Zustand besteht es aus planaren Moleküen SO3, die mit trimeren Molekülen im Gleichgewicht stehen.
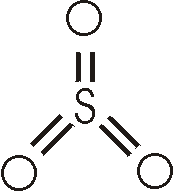
Beim Abkühlen erstarrt es zu farblosen Kristallen, die aus ringförmigen Molekülen (SO3)3 bestehen. In Anwesenheit von Spuren von Wasser kristallisiert faserförmiges Schwefeltrioxid, welches aus langen, kettenförmigen Molekülen besteht, die an den Enden OH-Gruppen tragen (genaugenommen ist dies eine Polyschwefelsäure). Schwefeltrioxid ist eine reaktionsfähige und stark oxidierend wirkende Substanz. Es ist ein Anhydrid der Schwefelsäure; mit Wasser reagiert es heftig unter Bildung der Säure und mit Oxiden bildet es Sulfate.
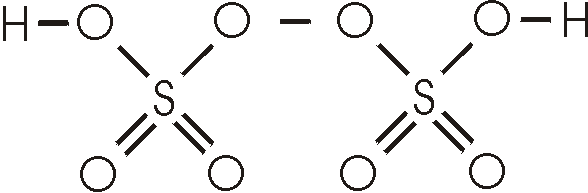
Schwefelsäure, H2SO4, ist eine der wichtigsten industriell hergestellten Chemikalien. Die Synthese erfolgt nach dem Kontaktverfahren, bei dem zunächst Schwefeldioxid hergestellt wird. Das SO2 wird an einem Katalysator zu SO3 weiteroxidiert. Weil die direkte Reaktion von SO3 mit Wasser nicht problemlos durchfühbar ist, wird das SO3 in Schwefelsäure eingeleitet, wobei sich Dischwefelsäure, H2S2O7, bildet. Durch Zusatz von Wasser wird dann die Schwefelsäure der gewünschten Konzentration erhalten.
H2S2O7 + H2O <--> 2H2SO4
Wenn man Schwefelsäure in Wasser einfließen läßt, so kommt es zu einer beträchtlichen Wärmeentwicklung. Schwefelsäure hat eine große Affinität zu Wasser und bildet damit eine Reihe von Hydraten. Schwefelsäure ist hygroskopisch, d.h. wasseranziehend, und kann deshalb als Trocknungsmittel eingesetzt werden. Gase, die nicht mit H2SO4 reagieren werden getrocknet, wenn sie durch Schwefelsäure hindurchgeleitet werden. Die wasseranziehende Wirkung kommt auch in der Reaktion mit Kohlenhydraten (Zucker) zum Ausdruck, die zu deren Verkohlung führt.
HSO4- <--> H+ + SO42-
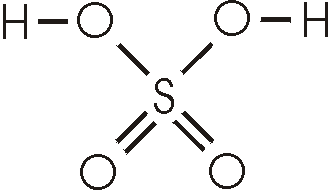
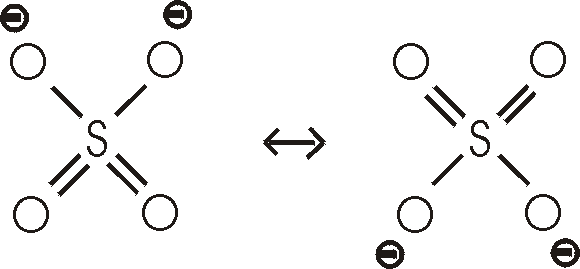
Im tetraedisch gebauten Sulfation sind alle vier Bindungen gleich.
Verdünnte Schwefelsäure ist bei Raumtemperatur nur ein schwaches Oxidationsmittel. Heiße konzentrierte Schwefelsäure wirkt stärker oxidierend. Auch Nichtmetalle wie Kohlenstoff werden von heißer , konzentrierter H2SO4 oxidiert. Unedle Metalle werden von verdünnter Schwefelsäure, wie von anderen Säuren auch, unter Wasserstoffentwicklung oxidiert. Konzentrierte Schwefelsäure greift auch edlere Metalle wie Kupfer und Silber an (nicht Gold und Platin), wobei kein Wasserstoff gebildet wird, sondern H2SO4 zu SO2 reduziert wird.
Cu + 2H2SO4 <--> CuSO4 + SO2 + 2H2O
Tellursäure wird durch die Einwirkung starker Oxidationsmittel auf elementares Tellur erhalten. Anders als H2SO4 und H2SeO4 hat sie die Zusammensetzung H6TeO6. Eine Verbindung der Zusammensetzung H2TeO4 ist bislang unbekannt obwohl Salze mit entsprechender Formel existieren. Tellursäure ist in wässriger Lösung eine schwache zweiprotonige Säure.
Es gibt einige weiter Säuren des Schwefels, in denen dem Schwefel die Oxidationszahl +VI zukommt. Die Dischwefelsäure, H2S2O7 (auch Pyroschwefelsäure genannt) oder auch die Peroxomonoschwefelsäure (H2SO5) und Peroxodischwefelsäure (H2S2O8). Eine Peroxosäure enthält in ihrem Molekül eine Peroxo-Gruppe "-O-O-".
Selen dient zur Herstellung von Photozellen, welche einen elektrischen Strom abgeben, dessen Stromstärke proportional zum einfallenden Licht ist. Wegen der photoelektrischen Eigenschaften des grauen Selens kommt es auch in Photokopiergeräten zum Einsatz. Selen wird zur Produktion von Farbgläsern, Pigmenten, Legierungen, Stahl, Oxidationsinhibitoren für Schmieröle und bei der Vulkanisation von Kautschuk verwendet.
Tellur findet vergleichsweise wenig Verwendung. Wie Selen wirkt es bei der Vulkanisation von Kautschuk und wird bei der Herstellung von Glas, Keramik, Legierungen und Emaillepigmenten verwendet.