| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Eine Reaktion setzt den Zusammenstoß von Molekülen voraus, doch führt nicht jeder Zusammenstoß zu einer Reaktion. Die Moleküle müssen in der richtigen räumlichen Orientierung aufeinandertreffen, zudem auch noch in ihrer Energie einen für die jeweilige Reaktion kennzeichnenden Grenzwert überschreiten.
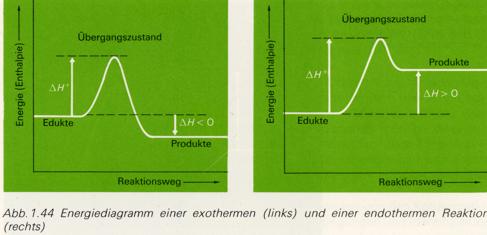
Dagegen kann aus dem "Energiegewinn" einer Reaktion, also aus der Differenz zwischen dem Energiegehalt
der Edukte und dem Energiegehalt der Produkte, auf die Stabilität geschlossen werden.
Bei einer Energieabgabe, die sich in einer Temperaturerhöhung der "Umgebung" zeigt, muß
der "innere Energiegehalt" der an der Umsetzung beteiligten Stoffe abnehmen. Daher wird bei dieser
exothermen Reaktion die Reaktionswärme mit einem negativen Vorzeichen versehen (den
beteiligten Teilchen wird Energie weggenommen).
Umgekehrt wächst bei einer endothermen Reaktion der Energiegehalt der Moleküle durch
"Wärmeaufmahme" an. Das Vorzeichen der Reaktionswärme ist daher positiv, die Teilchen haben
Energie gewonnen.
Die Reaktion kann in einem geschlossenen oder offenen "Gefäß" ablaufen. Im ersten Fall wird das Volumen konstant bleiben, doch kann sich der Druck ändern. In einem offenen System bleibt dagegen der Druck unverändert, doch kann sich das Volumen ändern, es muß also eine Volumenarbeit gegen den herrschenden Luftdruck geleistet werden, In der Regel betrachtet man die Zustandsänderung bei konstantem Druck und nennt diesen Energieumsatz die Enthalpieänderung (Delta H). Die Enthalpieänderung ist also die Wärmetönung bei konstantem Druck. In exothermen Reaktionen ist die Enthalpieänderung negativ, bei endothermen positiv.
Die Reaktionsfähigkeit einer Substanz (einem anderen Stoff gegenüber) wird durch die Reaktionsgeschwindigkeit
bestimmt. Diese hängt ab von der Häufigkeit der Moleküle (Konzentration), von der Wahrscheinlichkeit
des passenden Zusammenstosses (abhängig z.B. von der Molekülform) und vom Anteil der Moleküle, deren Energie die notwendige
Aktivierungsenergie überschreitet.
Dagegen hängt die Stabilität eines Stoffes (verglichen mit einem möglichen Reaktionsprodukt)
vom Unterschied im Energiegehalt ab.
Ein reaktionsfähiger Stoff wie Wasser braucht also nicht instabil zu sein; umgekehrt sind die reaktionsträgen
Alkane weniger stabil, da sie mit Sauerstoff in stark exothermer Reaktion in Wasser und Kohlendioxid übergehen können.
Reaktionen zwischen organischen Molekülen verlaufen oft recht langsam. Ihre Aktivierungsenergien sind also gewöhnlich ziemlich hoch. Viele Reaktionen sind umkehrbar und führen zu einem Gleichgewicht. Im Gleichgewicht überwiegen dann die Substanzen, deren Energie unter den gegebenen Umständen am kleinsten ist. Sind die Ausgangsstoffe stabiler als die Endprodukte, so liegt das Gleichgewicht "links" des Reaktionspfeiles, und die Ausbeute an den gewünschten Produkten ist nur dann genügend groß, wenn es gelingt, das Gleichgewicht zu "stören" und zu verschieben, beispielsweise dadurch, dass man ein Produkt aus dem Reaktionsgemisch entfernt (z.B abdestilliert).
Recht häufig können nun aber zwei Substanzen nicht nur in einer einzigen Weise miteinander reagieren, oder
es kann eine bestimmte Substanz mit zwei im Reaktionsgemisch enthaltenen anderen Substanzen gleichzeitig
reagieren. Es können also oft verschiedene Reaktionen nebeneinander ablaufen. In solchen Fällen
ist jeweils die Reaktion mit der geringsten Aktivierungsenergie die rascheste, auch wenn sie nicht zu den
stabilsten Produkten, d.h. nicht zu den energieärmsten aller möglichen Produkte führt.
Wird dann das reaktionsgemisch nach verhältnimäßig kurzer Zeit aufgearbeitet, so kann man die Produkte isolieren, welche
durch die schnellste Reaktion enstehen. Läßt man die Mischung aber längere Zeit stehen oder erhitzt etwas,
so erhält man hauptsächlich die energieärmsten (stabilsten) Produkte; die Reaktion ist dann durch die Gleichgewichtslage
(themodynamisch) gesteuert.

Die Abszissen (x-Achse) bilden in der Abbildung ein Maß für das fortschreiten der Reaktion, während auf der Ordinate (y-Achse) der
Energiegehalt der reagierenden Teilchen aufgetragen wird. Die Aktivierungsenergie erscheint als "Energieberg"
welcher überstiegen werden muß; je größer die Anzahl Teilchen, welche die nötige Aktivierungsenergie besitzen,
um so größer wird die Reaktionsgeschwindigkeit.
Den Gipfel dieses Energieberges bezeichnet man als Übergangszustand
oder aktivierter Komplex; er stellt den Zustand dar, in welchem sich reagierende Teilchen so weitgehend als überhaupt möglich
genähert haben und wo sich die alten Bindungen lösen, während gleichzeitig neue Bindungen entstehen.
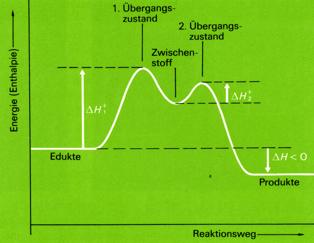 Viele Reaktionen laufen stufenweise, über eine Reihe von Teilvorgängen hinweg, ab. Im Verlauf der Gesamtrektion treten dann
vorübergehend Zwischenstoffe auf, die meist wenig stabil sind und sofort weiterreagieren.
Die Gesamt-Reaktionsgeschwindigkeit wird durch den langsamsten Teilschritt, also den Schritt mit der
größten Aktivierungsenergie (hier der erste Schritt) bestimmt.
Viele Reaktionen laufen stufenweise, über eine Reihe von Teilvorgängen hinweg, ab. Im Verlauf der Gesamtrektion treten dann
vorübergehend Zwischenstoffe auf, die meist wenig stabil sind und sofort weiterreagieren.
Die Gesamt-Reaktionsgeschwindigkeit wird durch den langsamsten Teilschritt, also den Schritt mit der
größten Aktivierungsenergie (hier der erste Schritt) bestimmt.
1. Bei Radikalreaktionen werden Bindungen homolytisch gespalten:
Manche Radikalreaktionen treten erst bei höheren Temperaturen oder unter dem Einfluß von Sonnen- oder Ultraviolettlicht ein; andere Radikalreaktionen werden durch Substanzen, die leicht in Radikale zerfallen, durch einzelne Atome oder durch "freie Radikale" (Moleküle mit ungeraden Elektronenzahlen oder mit einzelnen, ungepaarten Elektronen) ausgelöst. Gewisse Substanzen, die leicht mit Radikalen zu stabilen Produkten reagieren, werden als "Inhibitoren" für Radikalreaktionen verwendet, da sie eventuell entstehende Radikale abfangen und so eine mögliche Radikalreaktion verhindern können.
2. Häufig werden bei organischen Reaktionen Bindungen auch heterolytisch getrennt, wobei das bindende Elektronenpaar dem elektronegativeren Atom verbleibt:
Da bei solchen Reaktionen häufig Ionen auftreten, nennt man sie ionische (polare) Reaktionen. Solche Ionen bilden dann Zwischenstoffe einer mehrstufigen Reaktion. Wenn die heterolytische Trennung und die Neubildung von Bindungen in einem einzigen, kontinuierlichen Übergang erfolgt, verläuft die Gesamtreaktion in einem Schritt; im Übergangszustand werden dann die Bindungen gleichzeitig gelöst und neugebildet.
Die volständige heterolytische Bindungstrennung erfordert meist einen beträchtlichen Energieaufwand, da die entstehenden Ionen nur wenig stabil sind. Können sich die Ionen aber solvatisieren (in einem polaren Lösungsmittel), so wird dadurch ein beträchtlicher Teil der zur Trennung aufzuwendenden Energie kompensiert. Reaktionen, die über Ionen als Zwischenstoffe verlaufen, gehen deshalb fast ausschließlich in Lösung vor sich.
Wenn durch eine polare Reaktion eine Bindung neugebildet wird, so stellt der eine Reaktionspartner ein
Elektronenpaar für die Bindung zur Verfügung. Man bezeichnet ihn als nucleophil, weil er sich an ein
positiv geladenes oder wenigstens positiv polarisiertes Atom anlagert.
Das andere reagierende Teilchen verhält sich elektrophil, d.h. es lagert sich an ein freies Elektronnenpaar an.
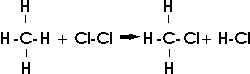
Auch wenn nur 1 mol Chlor mit 1 mol Methan umgesetzt wird, geht die Umsetzung jedoch weiter, da mit
abnehmender Methankonzentration immer häufiger auch die Monochlormethanmoleküle mit Chlor weiterreagieren.
Die Reaktion führt also zu einem Gemisch aus allen vier möglichen Chlormethanen (Di-, Tri-, Tetrachlormethan)
und nicht umgesetztem Methan.
Dabei unterscheiden sich die verschiedenen Halogene in ihrer Neigung zur Substitution beträchtlich: Mit
Fluor reagiert Methan bereits im Dunkeln äußerst heftig, langsamer verläuft die Chlorierung, noch langsamer
die Bromierung. Mit Iod erfolgt keine Reaktion.
Chlorierung und Bromierung können durch Bestrahlen mit Licht ausgelöst werden. Die Wirkung des Lichtes besteht darin, dass die Chlormoleküle Lichtenergie absorbieren, dadurch höhere Energie erhalten und beim Zusammenstoß mit anderen Molekülen homolytisch in Chlorradikale zerfallen:
Es handelt sich also um eine radikalische Substitution (SR-Reaktion). Der weitere Ablauf setzt einen Zusammenstoß dieses Chlorradikals mit einem Methanmolekül voraus. Die Reaktion mit einem anderen Chlorradikal ist äußerst selten, mit einem Chlormolekül ohne erkennbare Auswirkung. Bei der Reaktion mit dem Methanmolekül entsteht neben Chlorwasserstoff ein organisches Radikal (Methylradikal CH3.).
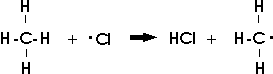
Das sehr reaktionsfähige Methylradikal kann mit Chlor- oder Methylradikalen weiterreagieren und dabei Monochlormethan oder Ethan bilden; doch sind diese beiden Reaktionen wegen der geringen Zahl dieser Radikale recht unwahrscheinlich. Die häufigste Reaktion erfolgt mit einem Chlormolekül:
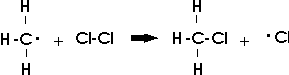
Dabei entsteht neben Chlorwasserstoff erneut ein Chlorradikal.
Es handelt sich bei der Chlorierung von Methan (Halogenierung von Alkanen) also um eine Kettenreaktion,
da in jedem Schritt ein reaktives Partikel produziert wird (Chlor- bzw. Methylradikal), die dden folgenden Reaktionsschritt
auslöst. Nach der Startreaktion (der vom Licht ausgelösten Spaltung des Chlormoleküls) folgen
die eigentlichen Kettenreaktionen:
CH3. + Cl2 -> CH3Cl + Cl.
Daher löst eine Startreaktion die Bildung von mehreren Tausend Chlormethanmolekülen aus.
Im Durchschnitt laufen die Kettenreaktionen etwa 5000mal ab, bevor es zu einem Kettenabbruch kommt.
Der Kettenabbruch erfolgt durch Vereinigung zweier Radikale:
CH3. + CH3. ->C2H6
CH3. + Cl. ->CH3Cl