| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Andererseits zersetzt sich Ammoniak bei ausreichend hohen Temperaturen wieder zu Stickstoff und Wasserstoff.
Die Reaktion ist reversibel, sie kann in beide Richtungen verlaufen. Um dies in einer Gleichung zum Ausdruck zu bringen, verwenden wir einen Doppelpfeil <--> (der ist eigentlich falsch, ich finde aber nicht das richtige Symbol im Compi; normalerweise zwei Pfeile übereinander).
Alle reversiblen Prozesse tendieren zum Erreichen eines Gleichgewichtszustands. Bei einer chemischen Reaktion wird der Gleichgewichtzustand erreicht, wenn die Reaktion in der einen Richtung (Hinreaktion) genauso schnell abläuft wie in der umgekehrten Richtung (Rückreaktion).
Betrachten wir die allgemeine reversible Reaktion
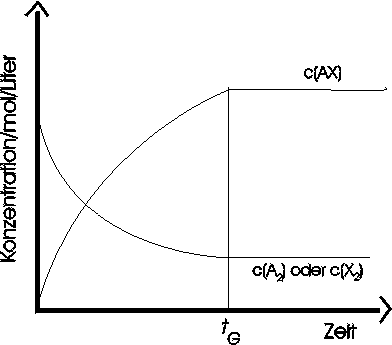
Nehmen wir an, wir vermischen A2 und X2 in einem Behälter. Sie werden reagieren und AX bilden (z.B.: H2 + I2 <--> 2HI). In dem Maße, wie die Hinreaktion abläuft, werden sich die Konzentrationen von A2 und von X2 verringern und dementsprechend wird die Reaktionsgeschwindigkeit abnehmen. Zu Beginn des Versuchs kann die Rückreaktion nicht stattfinden, da noch kein AX vorhanden ist. In dem Maße, wie während der Hinreaktion AX gebildet wird, setzt die Rückreaktion ein; sie verläuft anfangs langsam, da die AX-Konzentration noch klein ist, und wird dann allmählich schneller.

Nach einiger Zeit hat die Geschwindigkeit der Hinreaktion so weit abgenommen und die der Rückreaktion so weit zugenommen, daß beide gleich schnell verlaufen. Zu diesem Zeitpunkt (tG) hat sich das chemische Gleichgewicht eingestellt: Zwei entgegengesetzte Vorgänge laufen gleich schnell ab.
Im Gleichgewichtszustand bleiben die Konzentrationen (mol/Liter) aller beteiligten Substanzen konstant. Die Konzentration von AX bleibt konstant, weil es durch die Hinreaktion genauso schnell gebildet wird, wie es durch die Rückreaktion wieder verbraucht wird; entsprechendes gilt für A2 und X2. Es handelt sich um ein dynamisches Gleichgewicht. Nach wie vor wird ständig AX gebildet und verbraucht, die Konstanz der Konzentration, bedeutet nicht, daß die Einzelprozesse zum Stillstand gekommen sind.
Wenn sich also nach einer gewissen Zeit ein Gleichgewicht eingestellt hat, stehen die Konzentrationen der beteiligten Stoffe in einem mathematischen Verhältnis zueinander. Teilt man die Konzentrationen der Produkte durch die Konzentrationen der Edukte, kommt, bei gleichen Reaktionen, die gleiche Verhältniszahl (Gleichgewichtskonstante Kc) heraus (auch bei unterschiedlichen Konzentrationen der beteiligten Ausgangsstoffe).
Für unsere Beispielreaktion lautet die Verhältnisgleichung:
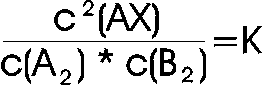
Die Konstante wird allgemein wie folgt formuliert:
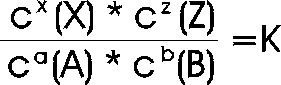
K beschreibt die konstanten Konzentrationsverhältnisse im Gleichgewichtszustand. Deswegen wird K auch die Gleichgewichtskonstante genannt. Die zugehörige Formel, wird das Massenwirkungsgesetz (MWG) genannt.
Der Zahlenwert von K ist temperaturabhängig. Bei einer gegebenen Temperatur stellen sich die Konzentrationen von A2, X2 und AX bei Erreichen des Gleichgewichts auf Werte ein, die nur bei dieser Temperatur möglich sind. Bei einer anderen Temperatur hat K einen anderen Zahlenwert, weil sich andere Konzentrationen einstellen.
Bei der Formulierung des Massenwirkungsgesetzes sind Stoffmengen- konzentrationen einzusetzen und deswegen wird die zugehörige Gleichgewichtskonstante häufig mit Kc bezeichnet. Der Zahlenwert von Kc muß für jede Reaktion und Temperatur experimentell ermittelt werden.
Der Zahlenwert der Gleichgewichtskonstanten vermittelt einen Eindruck von der Lage des Gleichgewichtes. Da die Konzentrationen der Substanzen auf der rechten Seite der Reaktionsgleichung im MWG in den Zähler kommen, bedeutet ein großer Zahlenwert von K ein Gleichgewicht mit hohen Konzentrationen dieser Substanzen. Man sagt, das Gleichgewicht „liegt auf der rechten Seite".
Das MWG gestattet die Voraussage über die Richtung, in der eine Reaktion ablaufen wird. Wenn sich eine Reaktion im Gleichgewicht befindet, hat K einen bestimmten Wert. Man kann aber auch eine Ausgangssituation wählen in denen der Quotient der Produkte/Edukte nicht K entspricht. Das bedeutet wenn dieser Quotient (Q) kleiner ist als K (Q < K) liegt kein Gleichgewicht vor. Die Reaktion wird von links nach rechts ablaufen, damit die Konzentrationen der Substanzen im Zähler von Q (rechte Seite der Reaktionsgleichung) zunehmen und die Konzentrationen der Substanzen im Nenner von Q (linke Seite der Reaktionsgleichung) abnehmen. Dadurch wird Q größer bis Q = K ist und dadurch das Gleichgewicht wieder erreicht ist.
Der Partialdruck eines Gases ist proportional zu seiner Stoffmengenkonzentration. Für Gase kann deshalb das MWG unter Verwendung von Partialdrücken an Stelle von Stoffmengenkonzentrationen formuliert werden. Die Gleichgewichtskonstante hat dann allerdings einen anderen Zahlenwert; sie wird Kp genannt.
Konzentrationsänderungen: Wird die Konzentration einer Substanz erhöht, so wird sich das Gleichgewicht so verlagern, daß die betreffende Substanz verbraucht wird und sich dadurch ihre Konzentration wieder erniedrigt.
Wenn sich H2 und I2 im Gleichgewicht mit HI befinden und die H2-Konzentration
durch Zusatz von H2 erhöht wird, so weicht das System aus, indem mehr HI gebildet
wird. Dabei wird H2 verbraucht. Wenn sich das Gleichgewicht wieder eingestellt hat,
so wird die HI-Konzentration größer sein als zu Beginn. Man sagt das Gleichgewicht
hat sich nach rechts verschoben.
Zusatz von HI verschiebt das Gleichgewicht nach links, unter Verbrauch von HI.
Nach Wiedereinstellung des Gleichgewichtes werden die Konzentrationen von H2
und I2 größer sein.
Auch die Entfernung einer Substanz aus dem Gleichgewichtssystem verlagert das
Gleichgewicht. Bei Wegnahme von HI verlagert es sich nach rechts unter Bildung
von weiterem HI und Verbrauch von H2 und I2.
Durch die fortwährende Entfernung eines Produktes kann eine Gleichgewichts-
reaktion zum vollständigen Ablauf in eine Richtung gezwungen werden.
Druckänderung: Bei der Reaktion
werden bei der Hinreaktion 2 mol Gas (2SO2) gebildet, während 3 mol Gas (2SO2 + 1O2) verbraucht. Wenn die Hinreaktion in einem geschlossenem Gefäß abläuft, verringert sich deshalb der Druck. Wenn sich das System im Gleichgewicht befindet und der Druck erhöht wird, weicht es aus, indem sich das Gleichgewicht nach rechts verlagert.. Bei Erniedrigung des Drucks verschiebt sich das Gleichgewicht nach links.
Temperaturänderungen: Die Ammoniaksynthese ist eine exotherme Reaktion; die zugehörige Rückreaktion ist endotherm.
Zufuhr von Wärme übt einen Zwang aus, dem durch Verbrauch von Wärme
ausgewichen wird; die endotherme Rückreaktion läuft ab, das Gleichgewicht
verlagert sich nach links. Bei Temperaturerniedrigung verschiebt sich das
Gleichgewicht nach rechts, das System gibt Wärme ab. Hohe Ausbeuten an NH3
werden erreicht, wenn die Temperatur möglichst niedrig ist. Ungünstigerweise läuft
die Reaktion bei niedrigeren Temperaturen extrem langsam ab, bis zur Einstellung
des Gleichgewichtes wären Millionen von Jahren notwendig. Die technische
Ammoniaksynthese wird bei Temperaturen um 500°C und hohen Drücken in
Anwesenheit eines Katalysators durchgeführt.
Eine Temperaturerhöhung begünstigt immer den endothermen Vorgang,
Temperaturerniedrigung den exothermen Vorgang.