Oxidationszahlen
und Redoxreaktionen
1)
Oxidationszahlen:
Bei
jeder Oxidation und Reduktion werden Elektronen verschoben. Sie wechseln von
einem Element zum anderen über. Die Veränderung macht sich bei den betreffenden
Elementen durch eine Wandlung ihrer elektrischen Ladung bemerkbar. Bei sehr
vielen einfachen chemischen Vorgängen haben wir solche Redox-Systeme
vorliegen. Vor allem aber spielen sich bei den komplizierteren
Reaktionen solche Verschiebungen ab – und davon kann man beim Aufstellen der
Gleichungen profitieren. Da Elektronen ebenso wenig wie Atome oder Moleküle
verloren gehen können, müssen sie stets irgendwo in der Gleichung wieder
aufzufinden sein, und das erleichtert die Suche nach den richtigen
Koeffizienten beträchtlich.
Bei
echten Ionenreaktionen können die Oxidationszahlen
leicht bestimmt werden. Sie entsprechen den Ladungen der einzelnen Ionen. Im
Magnesiumchlorid MgCl2 ist das Magnesium zweifach positiv geladen, es hat die
Oxidationszahl +2; das Chlor ist einfach negativ geladen, es hat die
Oxidationszahl -1.
Nun
sind aber nicht alle chemischen Reaktionen auch wirklich Ionenreaktionen.
Viele verlaufen nach anderen regeln – doch stört dies nicht in diesem
Zusammenhang: Man kann so tun, als bestünden alle Moleküle in Gleichungen aus
Ionen.
Damit
wird die chemische Wirklichkeit nicht richtig dargestellt, es erleichtert
allerdings das Gleichungschreiben beträchtlich.
Beispielsweise
ist das Wasser Molekül nicht ionisiert, trotzdem kann man es gedanklich in zwei
positiv geladenen Wasserstoffionen und ein zweifach
negativ geladenes Sauerstoffion zerlegen:
2 H+ und O2-
Hieraus
kann man schon die erste Regel ableiten:
Beim
Gleichungschreiben mit Hilfe der Oxidationszahlen
geht man immer davon aus, dass Wasserstoff in Verbindungen die Oxidationszahl
+1, Sauerstoff in Verbindungen die Oxidationszahl -2 hat.
Dadurch
ergeben sich sofort einige andere Oxidationszahlen, wenn man bedenkt, dass ein
Molekül nach außen hin neutral wirken muss.
Die
Formel der Salzsäure ist HCl. Da H beim gedanklichen Zerlegen des Moleküls
entsprechend obiger Regel H+ geschrieben werden muss, bleibt für
Chlor nur Cl-. Chlor ist in Chloriden demnach stets einfach negativ
geladen. Das gleiche gilt für alle Elemente der Halogene (Fluor, Chlor, Brom, Iod, Astat).
Demnach
kann man auch die Oxidationszahl des Eisens im Eisenchlorid FeCl2
bestimmen. Zwei negativen Chloridionen stehen hier
zwei positive Ladungen des Eisens gegenüber, also Fe2+. Eisen hat
somit die Oxidationszahl +2 im vorliegenden Eisenchlorid.
Es
gibt allerdings noch ein weiteres Eisenchlorid, das die Formel FeCl3
besitzt. Nach obigem Beispiel muss das Eisen in dieser Verbindung die
Oxidationszahl +3 haben.
Alle
bisher genannten Verbindungen könne als echte Ionenverbindungen
aufgefasst werden. Um mit diesen „echten“ Ionen nicht in Konflikt zu geraten,
werden die Oxidationszahlen nicht rechts oben hinter das Symbol geschrieben,
wie bei echten Ionenladungen üblich, sonder senkrecht
über das Symbol.
![]()
Nach
dem gleichen Prinzip kann man verschiedenen einfachen Molekülen ihre
Oxidationszahlen zuweisen.
![]()
Elemente,
die nicht in Verbindung vorliegen, sonder „elementar“ (reines Eisenmetall,
Gold, usw.) erhalten definitionsgemäß die Oxidationszahl 0. Auch die
elementaren Gase, die zweiatomig vorkommen (H2, O2, N2,
usw.), bekommen die Oxidationszahl 0 zugewiesen.
Nach
diesem System können die ersten Gleichungen gelöst werden.
Beim
Einleiten von Chlorgas in Eisen-(II)-chlorid-Lösung entsteht
Eisen-(III)-chlorid.
![]()
Man
erkennt deutlich, dass die beiden elementaren Chloratome mit der Oxidationszahl
o in zwei negativ geladene Chloridionen mit der
Oxidationszahl -1 übergehen. Sie haben also je ein Elektron aufgenommen.
Jedes
Chloratom hat sich ein Elektron von einem ![]() geholt, denn das Eisen taucht auf der rechten
Seite der Gleichung als
geholt, denn das Eisen taucht auf der rechten
Seite der Gleichung als ![]() auf, dieses hat also ein Elektron verloren, da
es um eine Oxidationsstufe positiver geworden ist.
auf, dieses hat also ein Elektron verloren, da
es um eine Oxidationsstufe positiver geworden ist.
Da
vom Chlor insgesamt zwei Elektronen aufgenommen wurden, sind auch zwei
Elektronen vom Eisen abgegeben worden; da aber jedes Fe nur ein Elektron zur
Verfügung stellt, müssen 2 Fe an der Reaktion beteiligt gewesen sein.
Die
Gleichung muss also lauten:
![]()
Das
ganze Wechselspiel läuft auf eine Redox-Reaktion
hinaus:
![]() (Abgabe
von 2 e-: Oxidation von Eisen)
(Abgabe
von 2 e-: Oxidation von Eisen)
![]() (Aufnahme von 2 e-: Reduktion von
Chlor)
(Aufnahme von 2 e-: Reduktion von
Chlor)
Training
mit Oxidationszahlen
1)
Zinn(II)-chlorid wird durch Sauerstoff und Salzsäure zu Zinn(IV)-chlorid
oxidiert, wobei gleichzeitig Wasser entsteht.
![]()
Das
Chlor in dieser Gleichung liegt rechts und links stets in Verbindung vor und
hat somit die Oxidationszahl -1. Genauso verhält es sich mit dem Wasserstoff H
der hier immer die Oxidationszahl +1 aufweist.
Sauerstoff
hingegen erscheint links elementar mit der Oxidationszahl 0 und rechts in
Verbindung mit der Oxidationszahl -2, es ist also reduziert worden.
![]() (Aufnahme von 2 * 2 e- = 4 e-; Sauerstoff ist
reduziert worden)
(Aufnahme von 2 * 2 e- = 4 e-; Sauerstoff ist
reduziert worden)
Zinn
ist das Element welches in der Reaktion oxidiert wurde. Im Zinn(II)-chlorid hat
Zinn die Oxidationszahl +2, da es mit 2 Cl mit der Oxidationszahl -1 verbunden
ist und nach außen hin neutral sein muss. Im Zinn(IV)-chlorid hat es die
Oxidationszahl +4, da nun 4 Chloratome mit ihm verbunden sind.
![]() (Abgabe von 2 e-; Zinn ist oxidiert worden)
(Abgabe von 2 e-; Zinn ist oxidiert worden)
Da
Sauerstoff 4 Elektronen aufnimmt, Zinn aber pro Atom nur 2 Elektronen liefert
müssen 2 Zinn-Atome in die Reaktion eingebracht werden. Molekularer Sauerstoff
liefert 2 Sauerstoff Atome, deswegen müssen auf der rechten Seite auch 2
Sauerstoff Atome auftauchen. Das erreicht man durch 2 H2O.
![]()
Der
Redox-Vorgang ist damit abgeschlossen und die
Gleichung muss nur noch ausgeglichen werden. Auf der rechten Seite befinden
sich 8 Cl, diese können durch Zugabe von 4 HCl (natürlich plus der 2 SnCl2)
auf der linken Seite eingebracht werden.
![]()
2)
Schwefelige Säure oxidiert an der Luft zu Schwefelsäure.
![]()
Sauerstoff
liegt links im elementaren Zustand vor und hat somit die Oxidationszahl 0. Auf
der rechten (und linken Seite kommt) es in Verbindung vor und hat die
Oxidationszahl -2.
![]() (Aufnahme von 2 * 2 e- = 4 e-; Sauerstoff ist
reduziert worden)
(Aufnahme von 2 * 2 e- = 4 e-; Sauerstoff ist
reduziert worden)
Schwefel
S liegt im H2SO3 mit der Oxidationszahl +4 vor. Das
Molekül ist nach außen elektrisch neutral. Die Oxidationszahlen von O (-2) und
H (+1) sind bekannt. Sauerstoff O kommt 3-mal vor, also 3 * -2 = -6 und
Wasserstoff H 2-mal, d.h. 2 * +1 = +2.
Die Summe der vorkommenden H und O Atome ergibt -4 ([-6] + [+2]
= -4). Diese Ladung -4 muss der Schwefel ausgleichen, daher wird ihm die
Oxidationszahl +4 zugewiesen, damit das Molekül nach außen hin neutral
erscheint.
![]()
Über
die gleiche Methode berechnet man die Oxidationszahl des Schwefels im H2SO4
und erhalten für Schwefel in dieser Verbindung die Oxidationszahl +6.
![]()
Beim
Übergang von schwefeliger Säure in Schwefelsäure muss also jedes Schwefel-Atom
2 Elektronen abgeben.
![]()
Beim
Übergang von O2 in den Sauerstoff der Verbindung H2SO3
wurden 4 Elektronen aufgenommen. Um 4 Elektronen zu liefern benötigen wir 2
Schwefelatome. Folglich lautet die
Gleichung:
![]()
3)
Durch Reduktion von Dibortrioxid mit metallischem
Magnesium erhält man Bor.
![]()
Welche
Oxidationszahl hat Bor in dem Dibortrioxid (B2O3)?
Bor
ist mit 3 Sauerstoffatomen verbunden. Jedes dieser O-Atome erhält
konventionsgemäß die Oxidationszahl -2, zusammen ist das -6.
Diese
-6 müssen die beiden Bor-Atome ausgleichen, da die Ladung des Moleküls Null ist,
erhalten beide Bor-Atome die Oxidationszahl +3 (2 * +3 = +6). Jetzt gleichen
sich die beiden Ladungen zu Null aus ([Sauerstoff]-6 + [Bor]+6 = 0 [B2O3]).
Auf
der rechten Seite der Gleichung liegt Bor in elementarem Zustand vor (B), seine
Oxidationszahl ist 0.
Bei
der Reaktion nimmt Bor 2 * 3 = 6 Elektronen auf:
![]()
Bor
ist somit reduziert worden.
Oxidationszahl
des Magnesiums:
Magnesium
liegt auf der linken Seite im elementaren Zustand vor. Es hat somit die
Oxidationszahl 0.
Auf
der rechten Seite ist Mg mit einem Sauerstoff-Atom verknüpft (MgO). Dieses Molekül ist ungeladen und Sauerstoff hat immer
die Oxidationszahl -2. Um diese Ladung des O-Atoms auszugleichen erhält
Magnesium in dieser Verbindung die Oxidationszahl +2.
![]()
Um
die 6 Elektronen für das Bor bereitstellen zu können, benötigt man für die
Reaktion 3 Mg.
Also
lautet die Gleichung:
![]()
Merksätze:
Unter
der Oxidationszahl versteht man diejenigen Ladungen, die ein Atom in einem
Molekül besäße, wenn das Molekül aus lauter Ionen aufgebaut wäre.
Man
kann die Oxidationszahl eines Elements leicht ausrechnen, wenn man sich merkt:
-
H hat die Oxidationszahl +1 (Ausnahme: HLi)
-
O hat die Oxidationszahl -2,
-
und das Gesamtmolekül muss neutral sein.
-
Freie Elemente bekommen definitionsgemäß die Oxidationszahl 0.
-
In vielen Verbindungen haben Halogene
(7.HG) die Oxidationszahl -1.
-
Alkalimetalle (1.HG) haben immer die Oxidationszahl +1.
-
Erdalkalimetalle (2. HG) haben immer die Oxidationszahl +2.
4)
Welche Oxidationszahl hat das Chrom im Kaliumdichromat?
Kaliumdichromat besitzt die Formel K2Cr2O7.
Kalium
(K) befindet sich in der 1. Hauptgruppe, und hat somit die Oxidationszahl +1.
Sauerstoff (O) bekommt wie immer die Oxidationszahl -2 zugewiesen.
Die
Zwischensumme für dieses Molekül lautet:
2
* +1 (vom K) + 7 * -2 (vom O) = -12
Diesen
Wert von -12 müssen die zwei übrigen Cr-Atome ausgleichen, somit erhält jedes
Cr die Oxidationszahl +6 (2* +6 = +12).
Die
zugewiesenen Oxidationszahlen lauten somit:
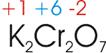
5)
Welche Oxidationszahl hat der Stickstoff (N) in der Salpetersäure HNO3?
H
hat die Oxidationszahl +1, Sauerstoff -2.
Die
Zwischensumme für dieses Molekül lautet:
1
* +1 (vom H) + 3 * -2 (vom O) = -5
Diese
-5 muss das Stickstoff-Atom ausgleichen und erhält dadurch die Oxidationszahl
+5 zugewiesen.
![]()
6)
Welche Oxidationszahl hat Stickstoff im Ammoniumchlorid
(NH4Cl)?
H
hat die Oxidationszahl +1, Chlor hat die Oxidationszahl -1 (7. HG!!!).
Zwischensumme:
4
* +1 (vom H) + 1 * -1 (vom Cl) = +3
Also
hat Stickstoff (N) im Ammoniumchlorid die
Oxidationszahl -3
![]()
7)
Welche Oxidationszahl hat Mangan (Mn) im Kaliumpermanganat
(KMnO4)?
K
hat die Oxidationszahl +1 (1.HG), Sauerstoff -2.
Zwischensumme:
1
* +1 (vom K) + 4 * -2 (vom O) = -7
Mangan
hat im Kaliumpermanganat die Oxidationszahl +7.
![]()
8)
Welche Oxidationszahl hat Platin (Pt) im Kalium-hexachloroplatinat
(K2[PtCl])?
K
hat die Oxidationszahl +1 (1.HG), Chlor -1 (7.HG).
Zwischensumme:
2
* +1 (vom K) + 6 * -1 (vom Cl) = -4
Platin
hat im Kalium-hexachloroplatinat die Oxidationszahl
+4.
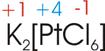
9)
Welche Oxidationszahl hat Wolfram in der Metawolframsäure (H8W12O40)?
Wasserstoff
hat die Oxidationszahl +1, Sauerstoff -2.
Zwischensumme:
8
* +1 (vom H) + 40 * -2 (vom O) = -72
Zur
Neutralisation des Moleküls sind also 72 positive Ladungen nötig. Diese teilen
sich die 12 Wolfram-Atome, jedes W erhält 6 positive Ladungen (+72 : 12 = +6). Die Oxidationszahl des Wolframs beträgt +6.
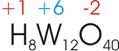
10)
Welche Oxidationszahl hat Stickstoff im Hydrazin (H2N-NH2)?
Elemente
die „ihresgleichen“ binden erhalten die Oxidationszahl 0 (Cl-Cl, H-H, O-O,
etc.). Für die Bindung N-N im Hydrazin wird also
beiden Stickstoff-Atomen die Oxidationszahl 0 zugewiesen. Nur die beiden H an
jedem Stickstoff zählen in dieser Verbindung.
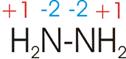
2) Redoxreaktionen
Die
Oxidationszahlen sind zum Lösen von Redoxgleichungen
sehr hilfreich.
Um
Gleichungen allerdings überhaupt Lösen zu können, müssen Ausgangsstoffe und
Endprodukte bekannt sein.
Eine
solche Reaktionsgleichung, deren Massen nicht ausgeglichen sind, nennt man
„Gerippe“.
1)
Salpetersäure oxidiert Jod zu Jodsäure, wobei noch Stickoxid und Wasser
gebildet wird.
![]()
Zuerst
muss man festlegen welche Atome ihre Oxidationszahl ändern.
|
Rechte Seite (Edukte, Ausgangsstoffe): |
Linke Seite (Produkte): |
|
Stickstoff in HNO3:
+5 Jod in elementarem
Zustand: 0 |
Jod
in HJO3: +5 Stickstoff
in NO: +2 |
Alle
Sauerstoff- und Wasserstoff-Atome haben ihre Oxidationszahl beibehalten.
Zur
Erleichterung wird eine Gleichung aufgebaut, die nur die Atome beinhaltet, die
auch ihre Oxidationszahl ändern:
![]()
Jeder
Stickstoff (N) geht von +5 in +2 über, nimmt also 3 Elektronen auf, wird
reduziert.
Jedes
Jod (J) geht von 0 in +5 über, gibt also 5 Elektronen ab, wird oxidiert.
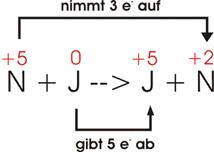
Damit
ebensoviel Elektronen aufgenommen wie abgegeben werden können, müssen 5 N und 3
J in die Gleichung eingebracht werden.
N
nimmt je Atom 3 Elektronen auf: 5 * 3 e-
= 15 e-
J
gibt je Atom 5 Elektronen ab: 3 * 5 e- = 15
e-
Damit
sind die Koeffizienten der Atome die ihre Oxidationszahl ändern gegeben.
![]()
Die
Wasserstoff- und Sauerstoff-Atome müssen nun zwischen rechts und links
ausgeglichen werden. Auf der rechten Seite sind
![]()
2)
Schwefel wird durch konzentrierte Salpetersäure zu Schwefelsäure oxidiert,
wobei Stickstoff entsteht.
„Gerippe“-Gleichung:
![]()
Wieder
betrachten wir zuerst nur die Atome, die ihre Oxidationszahl ändern:
![]()
|
Edukte |
Produkte |
|
Schwefel elementar: 0 Stickstoff in HNO3:
+5 |
Schwefel in H2SO4:
+6 Stickstoff in NO: +2 |
Jeder
Schwefel geht von 0 in +6 über, gibt also 6 Elektronen ab, wird oxidiert.
Jeder
Stickstoff geht von +5 in +2 über, nimmt 3 Elektronen auf, wird reduziert.
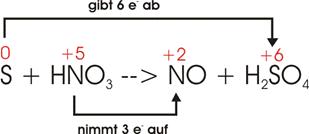
Stimmt
man das Aufnehmen und Abgeben der Elektronen wieder aufeinander ab, so sieht
man, dass 2 N in die Gleichung eingebracht werden müssen, um die 6 Elektronen
die der Schwefel abgibt, unterzubringen.
S
gibt 6 e- ab: 1 * 6 e- = 6 e-
N
nimmt 3 e- auf: 2 * 3 e- = 6 e-
Daraus
folgt die Gleichung:
![]()
Rechnet
man nach, so erkennt man, dass rechts und links in der Gleichung entsprechende
Mengen von Atomen stehen. Eine Ergänzung von Wassermolekülen oder dergleichen
auf einer der beiden Seiten ist nicht nötig.
3)
Phosphor wird durch konzentrierte Salpetersäure zu Phosphorsäure oxidiert,
wobei Stickoxid entsteht.
Gerippe:
![]()
Oxidationszahlen:
![]()
Elektronenverschiebung:
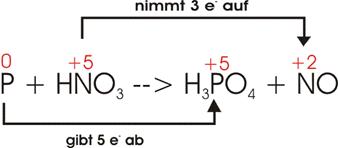
P
gibt 5 e- ab, es wurde oxidiert: 3
* 5 e- = 15 e-
N
nimmt 3 e- auf, es wurde reduziert: 5
* 3 e- = 15 e-
Zum
Ausgleich der 5 e- des Phosphors und der 3 e- des Stickstoffs setzt man die
entsprechenden Koeffizienten ein:
![]()
Damit
ist das Wesentliche schon erreicht; es folgt nur noch ein Ausgleich der H und O
zwischen links und rechts.
Rechts
sind im derzeitigen Zustand der Gleichung
![]()
Übungen:
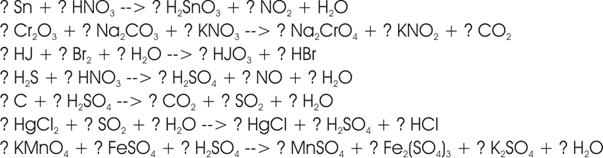
Lösungen:
3) Disproportionierung:
Bisher
wurden nur Redoxgleichungen behandelt, in denen die
beteiligten Atome von einer bestimmten Oxidationszahl zu einer anderen
wechselten.
Es
kommt jedoch nicht selten vor, dass ein Atom von einer bestimmten
Oxidationszahl sich in eine höhere und eine niedere Komponente
aufspaltet. Diese Erscheinung nennt man Disproportionierung.
Während
bisher lediglich Elektronenverschiebungen zwischen Atomen verschiedener
Elemente stattfanden, schieben sich in den folgenden Beispielen die Atome ein
und desselben Elementes ihre Elektronen gegenseitig zu.
1)
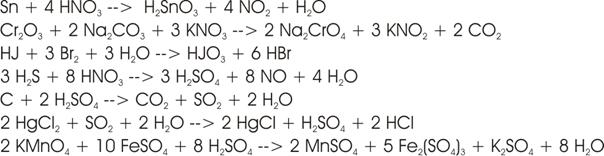
Salpetrige Säure (HNO2) neigt dazu sich beim Erwärmen in
Salpetersäure (HNO3) und Stickoxid (NO) aufzuspalten.
Rechnet
man die Oxidationszahlen für N in diesen Verbindungen aus, so erhält man:

Die
Oxidationszahl des N in HNO2 (+3) steht zwischen den beiden anderen
Werten HNO3 (+5) und NO (+2). Ein Teil der Moleküle der salpetrigen
Säure (HNO2) oxidiert sich also beim Erwärmen (von +3 auf +5; Abgabe
von Elektronen), ein anderer Teil reduziert sich (von +3 auf +5; Aufnahme von
Elektronen)
Elektronenverschiebung:
Um
die Abgabe von 2 e- bei einem N zu kompensieren (unterer Pfeil), sind 2 mal 1
e-, also 2 N, nötig (oberer Pfeil). Insgesamt sind 3 N an der Reaktion
beteiligt:
![]()
Damit
ist die Elektronenverschiebung ausgeglichen. Auf der rechten Seite der
Gleichung fehlt jetzt noch ein H2O:
![]()
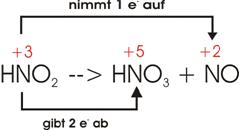
2)
Beim Erhitzen von Kaliumchlorat (KClO),
auf 400°C bildet sich Kaliumperchlorat (KCLO4)
und Kaliumchlorid (KCl).
Oxidationszahlen:

Elektronenverschiebung:
Damit
ein einziges Cl sechs Elektronen aufnehmen kann
(oberer Pfeil), müssen drei Cl je zwei Elektronen abgeben (unterer) Pfeil. Im
Ganzen sind dann vier Cl an der Reaktion beteiligt.
![]()
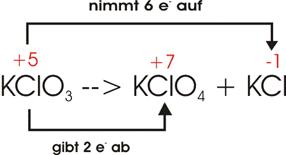
3)
Hypobromige Säure (HBrO),
disproportioniert sich beim Erwärmen unter Bildung von Bromwasserstoff (HBr) und Bromsäure (HBrO3).
Oxidationszahlen:
Elektronenverschiebung:
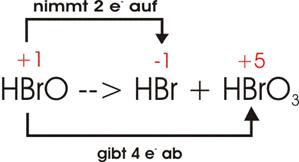
Damit
ein einziges Br vier Elektronen abgeben kann (unterer Pfeil), müssen zwei Br je
zwei Elektronen aufnehmen; im Ganzen sind also drei Br am Vorgang beteiligt:
![]()
4)
Beim Erwärmen mit Wasser (H2O) disproportioniert sich weißer
Phosphor zum teil in Phosphorwasserstoff (PH3) und hypophosphorige Säure (H3PO2).
Oxidationszahlen:
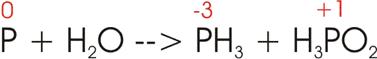
Elektronenverschiebung:
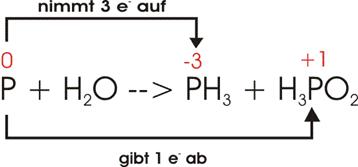
Damit
ein einziges P drei Elektronen aufnehmen kann (oberer Pfeil), müssen drei P je
ein Elektron abgeben (unterer Pfeil); im Ganzen sind vier P am Vorgang
beteiligt:
![]()
Die
Anzahl der H und O muss noch auf beiden Seiten ausgeglichen werden. Links sind
![]()
Gleichungen
in denen Disproportionierungen enthalten sind, sind
nicht selten. Mindestens ebenso häufig sind aber auch Fälle, in denen ein
Element in zwei verschiedene Oxidationsstufen übergeht, ohne das man dabei von
einer höheren und einer niederen sprechen kann.
5)
Bei der Oxidation von Schwefel (S) durch Salpeter (KNO3) bilden sich
Schwefeldioxid (SO2), elementarer Stickstoff (N2) und
Kaliumsulfat (K2SO4):
Oxidationszahlen:
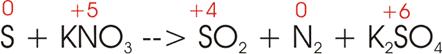
Währen
also der Stickstoff vollständig von der Oxidationszahl +5 auf die
Oxidationszahl 0 reduziert wird, treten die
Schwefelatome auf der rechten Seite teilweise als +4, teilweise als +6 auf. Da wegen
des Moleküls N2 mindestens zwei Stickstoffatome auf der linken Seite
vorkommen müssen, werden bei der Reduktion des Stickstoffs auch mindesten 2 mal
5 = 10 Elektronen benötigt.
Diese
10 Elektronen werden durch den Übergang eines S mit der Oxidationszahl 0 in den
Zustand eines S mit der Oxidationszahl +4 und eines S (0) in den Zustand S (+6)
zur Verfügung gestellt.
Elektronenverschiebung:

Somit
sind zwei Schwefelatome nötig, um das Elektronengleichgewicht wieder
herzustellen:
![]()
6)
Kaliumdichromat (K2Cr2O7)
reagiert mit Schwefelwasserstoff (H2S) unter Bildung von
Kaliumchromat (K2CrO4), Chromhydroxid
(Cr(OH)3) und Schwefel.
Oxidationszahlen:
![]()
Kaliumchromat
(K2CrO4) ändert seine Oxidationszahl nicht und kann aus
den Betrachtungen heraus gehalten werden.
Elektronenverschiebung:
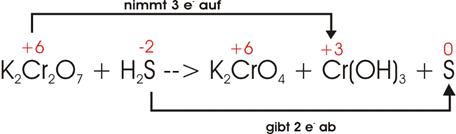
Damit
die beiden Cr des Kaliumdichromats (+6) auf die Stufe
des Chromhydroxids reduziert werden können, müssen
drei S von -2 auf 0 oxidiert werden:
![]()
Ladungsmäßig ist die Gleichung damit ausgeglichen. Nun müssen
die Atome, die ihre Ladung nicht geändert haben, noch ausbalanciert werden,
Auf
der rechten Seite ist ein Molekül K2CrO4 mit einem
überschüssigen Cr vorhanden. Da wir auf der linken Seite wegen des Vorkommens
zweier gekoppelter Cr im K2Cr2O7 nicht ein
einzelnes Cr hinzufügen können, geben wir auf beiden Seiten je ein Molekül
hinzu (links: K2Cr2O7; rechts: K2CrO4):
![]()
7)
![]()
Oxidationszahlen
und Elektronenverschiebung:
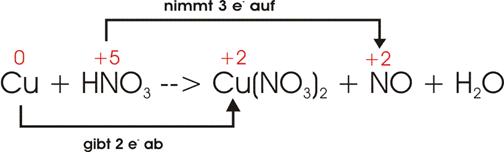
Ladungsausgleich:
![]()
Wegen
der drei mal 2 Nitratgruppen (NO3) auf der rechten Seite müssen wir
auch auf der linken Seite für zusätzliche 6 Nitratgruppen sorgen; das ergibt 8
HNO3 und somit auch 4 H2O.
![]()
8)
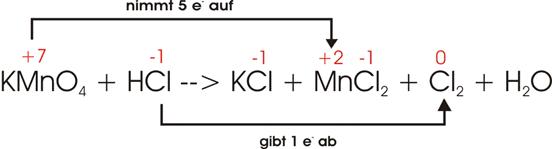
Ladungsausgleich:
![]()
Damit
sind die Ladungen ausgeglichen, doch befinden sich auf der rechten Seite 6 Cl
zuviel, die nur durch Zugabe von weiteren 6 HCl auf der linken Seite gedeckt
werden können. Also resultieren links 16 HCl. Auf diesem Wege erhalten wir die
richtige Menge H (16), um die 2 mal 4 = 8 Sauerstoffatome des Kaliumpermanganats zu oxidieren:
![]()
9)
![]()
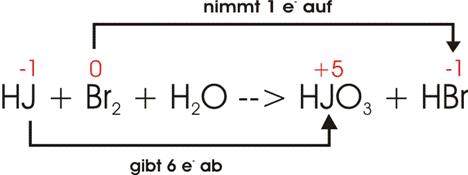
Ladungsausgleich:
![]()
Ausgleich:
![]()
Quelle: Vogt, „Chemische
Gleichungen – Ganz einfach“, Aulis Verlag Deubner&Co KG Köln. ISBN 3-7614-1793-4