| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Die wichtigsten Trennverfahren beruhen einerseits darauf, dass zu trennende Gemisch zwischen Verschiedenen Phasen verteilt wird oder das die Trennung nach verschiedener Teilchengröße/dichte geschehen kann. In Sonderfällen sind Trennungen durch chemische Reaktionen oder durch verschiedene Wanderungsgeschwindigkeiten im elektrischen Feld möglich.
1. Die Destillation dient zur Trennung (Reinigung) flüssiger oder leicht schmelzbarer
fester Stoffgemische. Vorraussetzungen sind hinreichende Flüchtigkeit und keine
Zersetzung der Komponenten beim Verdampfen.
Durch eine einfache (einmalige) Destillation eines Flüssigkeitsgemisches läst sich
meist keine vollkommene Trennung erreichen. Bei der fraktionierten Destillation
werden entweder die einzelnen Fraktionen für sich so lange weiter destilliert, bis
konstante Siedetemperaturen erreicht werden, oder man verwendet
Fraktionierkolonnen. Die schwerer flüchtigen Anteile des Dampfes kondensieren
darin zum größten Teil und tropfen in den Destillierkolben zurück.
Wenn zwei oder mehr Komponenten eines Gemisches azeotrope (konstant
siedende) Gemische bilden, ist eine Trennung durch gewöhnliche fraktionierte
Destillation nicht möglich. Man hilft sich in solchen Fällen vielfach in der Weise, dass
man dem Gemisch eine weitere Substanz zusetzt, welche ihrerseits mit einem der
abzutrennenden Stoffe eine azeotrope Mischung bildet. So lassen sich z.B. Alkohol
und Wasser durch fraktionierte Destillation nicht vollständig trennen; wird dem
Alkohol/Wasser-Gemisch jedoch Benzol zugesetzt, so destilliert zunächst eine
azeotrope Mischung von Benzol, Wasser und Alkohol ab, die das gesamte
vorhandene Wasser mit sich führt, so dass zum Schluss reiner (wasserfreier) Alkohol
überdestilliert.
2. Feste Substanzen können durch Umkristallisieren gereinigt werden. Dazu stellt man eine heiße gesättigte Lösung der Substanz in einem geeigneten Lösungsmittel her. Beim Abkühlen scheiden sich (reinere) Kristalle der gewünschten Substanz aus und die Verunreinigungen bleiben in der Lösung. Dieses Verfahren kann nur angewendet werden, wenn sich die betreffende Substanz in der Hitze gut, in der Kälte jedoch in geringerem Maße löst und wenn die Verunreinigung im verwendeten Lösungsmittel entweder in der Hitze nicht löslich sind (und daher durch Filtration der heißen Lösung abgetrennt werden können) oder – wenn gut löslich- beim Abkühlen gelöst bleiben.
Für die Laborpraxis von ganz besonderer Bedeutung sind die Extraktion und die
chromatographischen Methoden.
Im Prinzip beruhen beide darauf, dass sich die Bestandteile eines
Substanzgemisches unterschiedlich gut in zwei miteinander nicht mischbaren
Lösungsmitteln lösen und somit unterschiedlich auf die beiden Phasen verteilen.

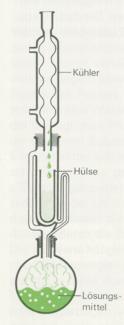
3. Bei der Extraktion löst man bestimmte Bestandteile eines Gemisches mit einem geeigneten Lösungsmittel heraus. Bei wasserlöslichen Stoffen kann dies Wasser sein, bei anderen Substanzgemischen eignen sich Alkohol, Ether, Benzin, Tetrachlormethan, Chloroform, Benzol, etc. Die Abbildung zeigt eine Soxhlet- Extraktionsapparatur: Das erhitzte Lösungsmittel kondensiert im aufgesetzten Rückflusskühler und tropft auf das Extraktionsgut, löst einzelne Bestandteile und fließt in den Kolben zurück. Durch diese kontinuierliche Methode geling es, selbst schwer extrahierbare Stoffe herauszulösen.
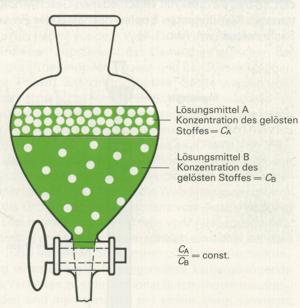
4. Beim Ausschütteln wird das Gemisch zwischen zwei Lösungsmitteln von beschränkter Mischbarkeit (z.B. Wasser und Ether) verteilt. Man erreicht dadurch einen Gleichgewichtszustand, der durch ein konstantes Verhältnis der Einzelkomponenten in den beiden flüssigen Phasen gekennzeichnet ist. Die Trennung geschieht im bekannten Scheidetrichter. Durch ein einmaliges Ausschütteln wird meist keine vollständige Trennung erreicht, da die Unterschiede in der Löslichkeit häufig nicht genügend groß sind. Daher muss man die Operation mehrfach wiederholen.
Die chromatographischen Verfahren zählen zu den wirkungsvollsten Trennmethoden überhaupt und sind darum auch für kleinste Substanzmengen anwendbar. Man benutzt dabei stets eine stationäre (unbewegliche) Phase (fein verteilter fester Stoff oder eine durch ein festes Trägermaterial stationär gehaltene Flüssigkeit/Gas) und eine mobile (bewegliche) Phase.
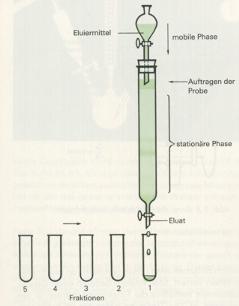
5. Bei der Säulenchromatographie ist die stationäre Phase eine feste, in ein senkrechtes Glasrohr eingefüllte Substanz (z.B Aluminiumoxid, Cellulose o.ä.). Die Lösung, welche das Substanzgemisch enthält, wird durch diese Säule geschickt, wobei die verschiedenen Komponenten des Gemisches je nach ihrem Charakter und den adsorbierenden Eigenschaften der Säule von dieser verschieden stark festgehalten werden, so daß sie diese mit verschiedenen Geschwindigkeiten passieren. Die dadurch getrennten Komponenten tropfen nacheinander (in verschiedenen Fraktionen) aus der Säule heraus.
6. Bei der Papierchromatographie trägt man die zu untersuchende Substanzprobe (10-6 bis 10-4 g)
auf den Rand eines Filterpapierstreifens auf und läßt ein mit Wasser gesättigtes Lösungsmittel über
das ebenfalls mit Wasser gesättigte Papier laufen. Stärker hydrophile Stoffe werden vom
stillstehenden Wasser zurückgehalten, schwächer hydrophile Substanzen wandern mit
der beweglichen Phase schneller vorwärts, wobei die Wanderungsgeschwindigkeiten der
einzelnen Substanzen von ihrer Verteilung zwischen Wasser und dem Betreffenden
Lösungsmittel abhängen.
Man erhält auf diese Weise eine Reihe von Substanzflecken, die gegebenenfalls durch
bestimmte Farbreaktionen sichtbar gemacht werden müssen.

Als Maß für die Wanderungsgeschwindigkeit dienen die "Rf-Werte"
(die Entfernung einer Substanz vom Ausgangspunkt dividiert durch die Entfernung
der Lösungsmittelfront ebenfalls vom Ausgangspunkt).
Die Rf-Werte hängen vom Lösungsmittel und von der Papiersorte ab,
sind aber bei gleichen Bedingungen (z.B.Temperatur) für die einzelnen Substanzen
charakteristische Konstanten.
7. Bei der Dünnschichtchromatographie gießt oder streicht man das Adsorptionsmittel
oder Trägermaterial als dünne Schicht auf eine Glasscheibe; sie bildet die stationäre,feste Phase
oder das Trägermaterial für eine stationäre flüssige Phase.
Die Substanzgemische werden auch hier am einen Rand der Glasplatte auf die dünne Schicht
aufgetragen. Die mobile Phase (die Lösung des Substanzgemisches) steigt senkrecht empor.
Neben der Verteilung zwischen zwei flüssigen Phasen, wie bei der Papierchromatographie,
spielen hier auch Adsorptionserscheinungen eine große Rolle.
8. Bei der Gaschromatographie wird das Substanzgemisch verdampft und zusammen mir einem inerten Trägergas (Helium oder Stickstoff), das die bewegliche Phase bildet, durch ein langes, dünnes Rohr geleitet. Als stationäre Phase dient eine nichtflüchtige Flüssigkeit, mit welcher ein Festkörpergranulat getränkt wurde oder die als dünner Film auf die Innenseite einer Kapillare von 0,2 bis 1 mm Durchmesser und bis zu 70 m Länge möglichst gleichmäßig aufgetragen wurde.
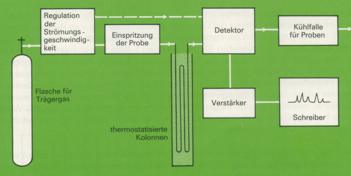
Die einzelnen Komponenten des Gemisches lösen sich je nach ihrem Charakter mehr oder weniger gut in der stationären Phase und werden von dieser mehr oder weniger stark zurückgehalten. Am Ende der Kolonne können sie somit nach kürzerer oder längerer Strömungszeit des Trägergases in einem Detektor nachgewiesen werden.
8. Während durch die Gaschromatographie nur Stoffe getrennt werden können, die selbst flüchtig sind, sich bei höheren temperaturen unzersetzt verdampfen oder von denen sich zumindest flüchtige Deivate herstellen lassen, erlaubt die Hochleistungs-Flüssigkeitschromatogrphie (High Performance Liquid Chromatographie, HPLC) eine ähnlich schnelle Auftrennung kleinster Substanzmengen, soweit diese in irgendeinem Lösungsmittel löslich sind. Diese Bedingung trifft nahezu für alle organischen Substanzen zu.
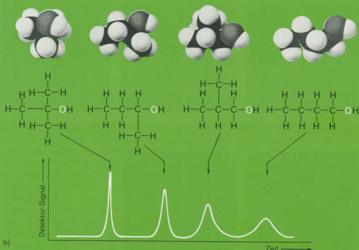
Die Materialprobe wird dem Lösungsmittel zugesetzt, das unter hohem Druck durch die Trennsäule gepreßt wird. Durch Unterschiede in der Adsorption der verschiedenen Gemischbestandteile an der Säulenfüllung oder durch unterschiedliche Löslichkeit in der (stationären) Flüssigkeit, mit der die Säulenfüllung belegt ist, und in den vorbeiströmenden (mobilen) Lösungsmitteln, werden die inzelnen Stoffe verschieden stark verzögert und verlassen die Trennsäule nacheinander. Der nachgeschaltete Detektor überprüft den austretenden Flüssigkeitsstrom und registriert jede Änderung in der UV-Absorption oder im Brechungsindex gegenüber dem reinen Lösungsmittel. Er liefert elektrische Signale, die von einem Schreiber wie bei der Gaschromatographie fortlaufend aufgezeichnet werden.
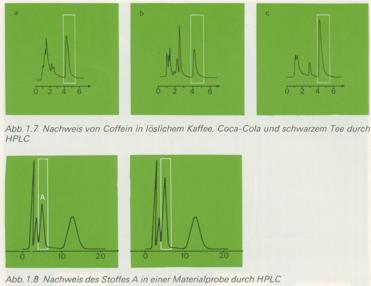
Die HPLC erlaubt die Auftrennung eines Substanzgemisches in verschiedene Fraktionen, die anschließend
analytisch untersucht werden können. Soll nur ein bestimmter Stoff in der Probe nachgewiesen werden,
so setzt man der Probe vor dem Einspritzen in die Säule eine winzige Menge des Vergleichsstoffes zu.
Wenn die Verzögerung (Retention) immer gleich ist und daher vom Detektor nur ein (gegenüber der
originalen Probe verstärktes) Signal aufgezeichnet wird, ist der Nachweis gesichert.