| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Die Konformation ist von der Konstitution und Konfiguration zu unterscheiden:
Die Konstitution eines Moleküls ist durch die Verknüpfung der Atome im Molekül festgelegt. Sie beschreibt, welche Atome mit welchen Bindungen aneinander gebunden sind. Verbindungen mit gleicher Summenformel, aber verschiedener Konstitution und damit verschiedenen chemischen und physikalischen Eigenschaften werden als Konstitutions- oder Strukturisomere bezeichnet.
Beispiele für diese Isomerien bilden Ethanol und Dimethylether, die "verschieden" verzweigten Kohlenwasserstoffe oder Alkene mit unterschiedlicher Lage der Doppelbindung.
Stehen mehrere Konstitutionsisomere miteinander in einem chemischen Gleichgewicht, wie z.B. die Keto- und die Enolform von Carbonylverbindungen, so spricht man von Tautomerie.
Besitzen dagegen Isomere die gleiche Konstitution, unterscheiden sich aber in der räumlichen Anordnung, so handelt es sich um stereoisomere Verbindungen. Die räumliche Anordnung der Moleküle - ohne Berücksichtigung der verschiedenen Atomanordnungen, die sich voneinander nur durch die Rotoation um Enfachbindungen unterscheiden - nennt man seine Konfiguration.
Ein Beispiel bietet die cis-trans-Isomerie.
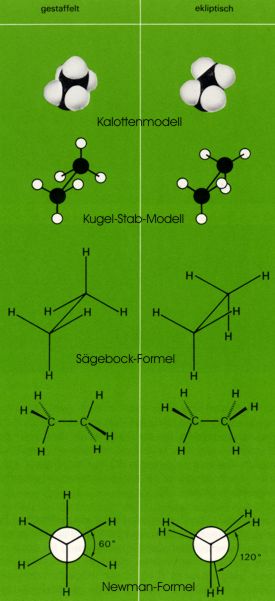
Die Konformation gibt die genaue räumliche Anordnung der Atome im Molekül wieder. Ein Molekül von bestimmter Konfiguration kann in unendlich vielen Konformationen existieren, von denen einzelne einem Energieminimum entsprechen und dann als Konforme bezeichnet werden. Im Ethanmolekül sind zwei Extremkonformationen von besonderem Interesse: die gestaffelte und die ekliptische Konformation.

Die Darstellung der Konformation ist mit Hilfe der üblichen Strukturformeln nicht möglich. Man verwendet perspektivische Formeln ("Sägebockformeln") oder die Newmanschen Projektionsformeln, die aus den entsprechenden perspektivischen Formeln leicht abgeleitet werden können.
Bei der gestaffelten Konformation stehen - wie die Newman-Formel zeigt - die Wasserstoffatome der beiden Methylgruppen "auf Lücke", bei der ekliptischen Konformation stehen sie "hintereinander".
Daher ist die gestaffelte Konformation stets energieärmer als die ekliptische. Die Energiedifferenzen sind zwar meist gering (wenige kJ/mol) und können deshalb durch die Energie der Wärmebewegung überwunden werden; bei Verbindungen mit verhältnismäßig großen , raumerfüllenden oder mit stark elektronegativen Substituenten (die sich abstoßen), können die Energiedifferenzen bis 40 kJ/mol betragen. (Die Energiebarriere zwischen cis- und trans Form ist nicht immer hoch. Beispiel:
nur 5,4 kJ/mol zwischen trans But-2-en und cis-But-2-en (Lit.: Beyer, Walter Lehrbuch der org. Chemie, 14. Auflage)).
Auch im Gaszustand treten deshalb die Moleküle vorwiegend in der energieärmsten - der gestaffelten - Konformation auf. Die ekliptischen Konformationen wirken bei der freien Rotation um die C-C-Bindung gewissermaßen als "Energiebarriere", setzen also der Drehung eine gewissen Widerstand entgegen und werden dabei nur rasch durchlaufen; sie sind also keine stabilen Zustände.
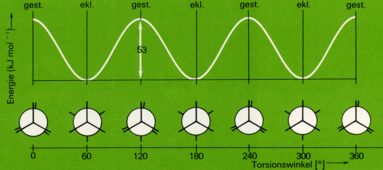
Eine Änderung der potentiellen Energie ist bei der Drehung der beiden Methylgruppen des Ethanmoleküls um die C-C-Achse zu beobachten.
Im Propan ist die Energiedifferenz zwischen gestaffelter und ekliptischer Konformation trotz der zusätzlich vorhandenen Methylgruppe nur wenig größer als beim Ethan.
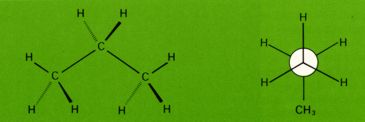 Die stabilste Konformation des Propan weist gestaffelte Bindungen auf.
Die stabilste Konformation des Propan weist gestaffelte Bindungen auf.
Beim n-Butan sind die Energiebarrieren zwischen den verschiedenen Konformationen dagegen wegen der stärkeren Wechslwirkung zwischen den beiden Methylgruppen erheblich vergrößert.
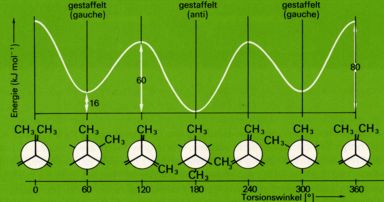 Bei der Drehung um die C2-C3-Achse sind zwei energetisch verschiedene gestaffelte und zwei energetisch verschiedene ekliptische Anordnungen möglich. Am energieärmsten ist die Konformation mit einer ekliptischen Stellung der beiden Methylgruppen, am energieärmsten die gestafelte Anordnung der beiden Methylgruppen.
Bei der Drehung um die C2-C3-Achse sind zwei energetisch verschiedene gestaffelte und zwei energetisch verschiedene ekliptische Anordnungen möglich. Am energieärmsten ist die Konformation mit einer ekliptischen Stellung der beiden Methylgruppen, am energieärmsten die gestafelte Anordnung der beiden Methylgruppen.
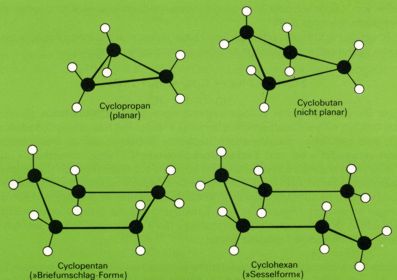
Im Gegensatz zu den aromatischen Molekülen sind die Moleküle alizyklischer Moleküle meist nicht eben gebaut, eine Folge der tetraedrischen Richtung der Bindungen im gesättigten Kohlenstoffatom.
Der Cyclopropan-Ring ist eben gebaut; dagegen besitzt das Cyclobutan keine ebene Struktur: Drei Kohlenstoffatome liegen in einer Ebene, das Kohlenstoffatom der vierten Ecke ist aus der Ebene herausgehoben.
Das Cyclopentan würde als ebenes Fünfeck einen CCC-Winkel von 108° erreichen, so daß keine Ringspannung zu erwarten wäre. Doch wären dann alle Wasserstoffatome zueinander in ekliptischer Stellung. Energetisch günstiger ist die "Briefumschlag "-Gestalt: Ein Fünfring mit vier Ecken in einer Ebene und einer "hochgeschlagenen" fünften Ecke.
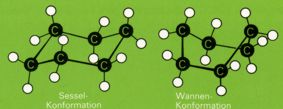 Der in vielen Naturstoffen auftretende Cyclohexanring kann in mehreren Konformationen vorkommen. Die stabilste Form ist die "Sessel-Konformation", bei der jeder CCC-Winkel gleich dem Tetraederwinkel ist und alle Wasserstoffatome gestaffelt angeordnet sind. Dies ist in der "Wannenform" des Cyclohexans nicht der Fall. Daher tritt das Cyclohexan normalerweise ausschließlich in der Sesselkonformation auf.
Der in vielen Naturstoffen auftretende Cyclohexanring kann in mehreren Konformationen vorkommen. Die stabilste Form ist die "Sessel-Konformation", bei der jeder CCC-Winkel gleich dem Tetraederwinkel ist und alle Wasserstoffatome gestaffelt angeordnet sind. Dies ist in der "Wannenform" des Cyclohexans nicht der Fall. Daher tritt das Cyclohexan normalerweise ausschließlich in der Sesselkonformation auf.

Freie Drehbarkeit wie bei einer C-C-Einfachbindung, ist bei einer Doppelbindung nicht mehr gegeben. In allen Fällen, in denen die beiden Kohlenstoffatome der Doppelbindung mit zwei verschiedenen Atomen bzw. Atomgruppen verbunden sind, sind zwei räumliche Anordnungen möglich, welche man als cis- und trans-Form unterscheidet.
Die Energiebarriere zwischen den beiden Formen ist so hoch, daß die Substituenten in einer starren Anordnung verharren und die beiden räumlichen Anordnungen als stabile Isomere isoliert und untersucht werden können. Die Umwandlung der beiden Formen ineinander (unter Trennung einer Bindung der Doppelbindung) kann meist erst bei ziemlich hoher Temperatur (oder enzymatisch) erreicht werden. Nur in gewissen Fällen, wo aus räumlichen Gründen (Raumbeanspruchung der Substituenten) das eine Isomer (gewöhnlich die trans-Form) viel stabiler ist als das andere, tritt die Isomerisierung (d.h. die Umlagerung des weniger stabilen in das stabilere Isomer) bereits bei relativ tiefer Temperatur ein.
Das klassische Beispiel eines cis/trans-Isomerenpaares bilden Malein- und Fumarsäure. Beide Säuren entsprechen den Formeln HOOC-CH=CH-COOH, unterscheiden sich jedoch stark in ihren Eigenschaften.
| Maleinsäure | Fumarsäure | |
|---|---|---|
| Schmelzpunkt (°C) | 130 | 287 |
| Löslichkeit in Wasser (g/cm3 bei 25 °C) | 78,9 | 0,7 |
| Dichte (g/cm3) | 1,590 | 1,635 |
| Verbrennungswärme (MJ/mol) | 1,37 | 1,34 |
| pKs1 | 1,9 | 3,0 |
| pKs2 | 6,5 | 4,5 |
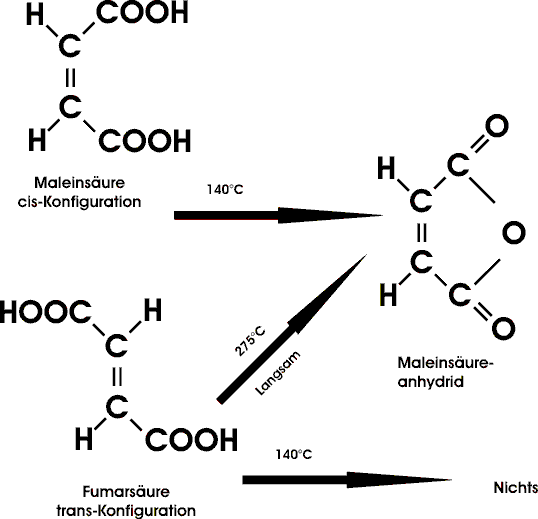
Auch der Unterschied in den Verbrennungswärmen der beiden Substanzen zeigt, daß die Fumarsäure um knapp 30 kJ/mol stabiler ist als Maleinsäure. Sie entspricht der trans-Form; Maleinsäure, die weniger stabile, aber stärkere Säure, ist die cis-Form.
Hier wie übrigens in zahlreichen Fällen von cis/trans-Isomerie bildet die trans-Form auch das stabilere Gitter (höhere Gitterenergie), was sich im höheren Schmelzpunkt und in der geringeren Löslichkeit deutlich zeigt. Von Interesse ist, das sich das energiereichere cis-Isomer unter der Wirkung von Katalysatoren wie Chlorwasserstoff oder Bromwasserstoff bereits bei Zimmertemperatur in die trans-Säure umlagert. Offenbar findet dabei eine vorübergehende Addition der Halogenwasserstoffmoleküle an die Doppelbindung statt; die Elimination führt dann hauptsächlich zum stabileren Isomer.
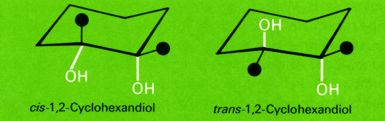 Die Hydroxylgruppen liegen in einem Fall benachbart (cis-Form), im anderen Fall relativ weit voneinander entfernt (trans-Form). Beide Verbindungen können nicht durch Drehung um eine Bindungsachse, sondern nur durch Sprengung von Bindungen ineinander umgewandelt werden. Es handelt sich also nicht um Konformationen einer Verbindung, sondern um Konfigurationsisomere.
Die Hydroxylgruppen liegen in einem Fall benachbart (cis-Form), im anderen Fall relativ weit voneinander entfernt (trans-Form). Beide Verbindungen können nicht durch Drehung um eine Bindungsachse, sondern nur durch Sprengung von Bindungen ineinander umgewandelt werden. Es handelt sich also nicht um Konformationen einer Verbindung, sondern um Konfigurationsisomere.
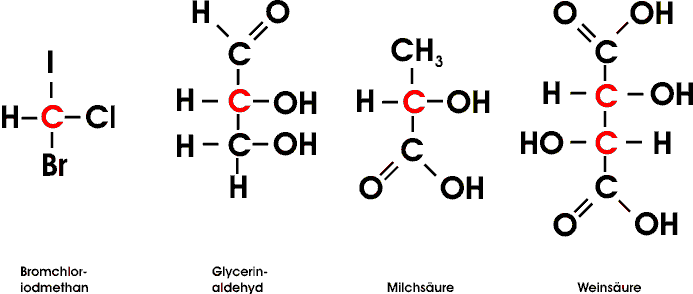
Dabei dreht die eine Form die Schwingungsebene des linear polarisierten Lichtes nach rechts, die andere um genau den gleichen Betrag nach links. Das Ausmaß der Drehung hängt dabei von der Konzentration der betreffenden Substanz, ihrer Schichtdicke und von der Wellenlänge des benutzten Lichtes ab;
das Drehvermögen (die "optische Aktivität") ist also auch in verdünnter Lösung zu beobachten und muß eine charakteristische Eigenschaft der betreffenden Moleküle sein.
Zur Untersuchung optisch aktiver Substanzen benutzt man ein Polarimeter. Dieses besteht aus einer monochromatischen Lichtquelle, einem ersten Polarisationsfilter ("Polarisation", da er nur Licht mit einer ganz bestimmten Schwingungsebene durchläßt), der Küvette mit der zu untersuchenden Lösung und einem zweiten Polarisationsfilter ("Analysator").

Zunächst wird die Küvette mit einer optisch inaktiven Flüssigkeit (z.B. Wasser) gefüllt und dann der Analysator so lange gedreht, bis hinter ihm eine maximale Lichtauslöschung (dunkel) zu beobachten ist: Stellung des Analysators senkrecht zur Stellung des Polarisators. Wird das Wasser z.B. durch Glycerinaldehyd ersetzt, so muß der Analysator - um erneut maximale Auslöschung zu erhalten - um einen bestimmten Winkel gedreht werden.
Um einen Vergleich verschiedener Substanzen und verschieden konzentrierter Lösungen zu ermöglichen, wird der "spezifische Drehwinkel" (Alpha) auf die Konzentration 1 g/cm3 der Lösung, auf die Küvettenlänge 10 cm und das gelbe Licht einer Natriumlampe bezogen.
Auch Temperatur und Art des Lösungsmittels haben einen Einfluß auf den Drehwinkel. Schmutz auf der Küvette verhindert eine exakte Messung.
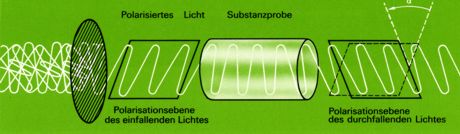
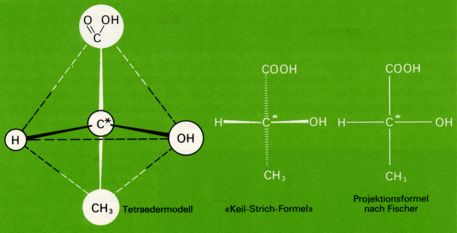
Der häufigste Fall von Molekülasymmetrie kommt dadurch zustande, dass die betreffenden Moleküle ein Kohlenstoffatom enthalten, das mit vier verschiedenen Substituenten verbunden ist ("asymetrisches Kohlenstoffatom", in Formeln meistens als C* bezeichnet oder rot gekennzeichnet ) und das Chiralitätszentrum darstellt. Als Folge der tetraedischen Richtung der vier Bindungen sind dann zwei verschiedene, zueinander spiegelbildliche Anordnungen der Substituenten möglich.
Um die Konfiguration eines Moleküls mit asymetrischen Kohlenstoffatomen wiedergeben zu können, benutzt man vielfach die von Fischer vorgeschlagenen Projektionsformeln.
Man ordnet dabei die C-C-Ketten vertikal und hält den "Tetraeder" so, dass das Kohlenstoffatom mit der höchsten Oxidationszahl (bei der Milchsäure das Kohlenstoffatom der Carboxylgruppe, beim Glycerinaldehyd das Kohlenstoffatom der Aldehydgruppe) nach oben gerichtet ist. Nun denkt man sich das asymetrische C*-Atom in der Bildschirmebene; die beiden Bindungen welche nach vorne (aus dem Bildschirm raus) gerichtet sind, werden durch horizontale Striche, die beiden nach hinten gerichteten Bindungen durch vertikale Striche veranschaulicht.
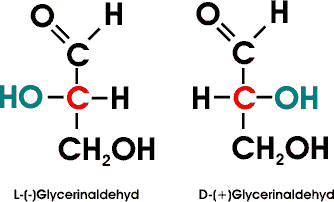
Es gelang erst 1951, die wirkliche Anordnung der Substituenten am asymetrischen Kohlenstoffatom des D-Glycerinaldehyds zu bestimmen, indem ein Salz der Weinsäure röntgenographisch untersucht und dann dessen Konfiguration mit der Konfiguration des D-Glycerinaldehyds in Beziehung gesetzt werden konnte. Dabei ergab sich , dass - zufälligerweise! - die vorher angenommene Konfiguration der tatsächlich vorhandenen Anordnung entspricht.
Alle Moleküle, die sich vom D-Glycerinaldehyd ableiten oder mit diesem in Beziehung gebracht werden können, werden ebenfalls als D-Verbindungen bezeichnet. Die Bezeichnung sagt indessen nichts über den wirklichen Drehsinn eines bestimmten Enantiomers aus (D-Milchsäure z.B. dreht polarisiertes Licht nach links), sondern will nur die räumliche Anordnung der Substituenten, die Konfiguration, zum Ausdruck bringen. Die Drehung einer bestimmten Substanz wird dann zusätzlich mit (+) - rechtsdrehend - oder (-) - linksdrehend - angegeben.
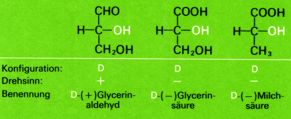
Die sich auf den D-Glycerinaldehyd gründende Nomenklatur bewährte sich insbesondere bei den als Naturstoffen sehr wichtigen Kohlenhydraten und Aminosäuren; sie konnte jedoch für die sehr zahlreichen Verbindungen, welche in keinerlei Beziehung zum Glycerinaldehyd gesetzt werden konnten, nicht verwendet werden.
Um die Konfiguration jedes beliebigen asymetrischen Kohlenstoffatoms eindeutig wiederzugeben, wurde 1956 eine neue Bezeichnungsweise vorgeschlagen, bei welcher man das asymetrische Kohlenstoffatom in einer ganz bestimmten Weise betrachtet und dazu den verschiedenen Substituenten verschiedenes "Gewicht" beilegt.
Ein Beispiel für die Diastereomerie ist die bereits behandelte cis/trans-Isomerie.
Man findet sie aber auch bei Molekülen mit mehreren asymetrischen Kohlenstoffatomen.
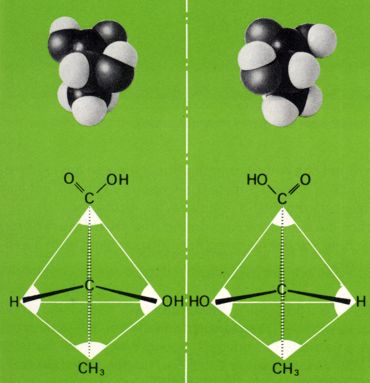
Ein Beispiel bietet die Weinsaüre: D- und L-Weinsäure sind spiegelbildlich zueinander und als Enantiomere in ihren chemischen und physikalischen Eigenschaften weitgehend gleich. Daneben existiert eine Mesoweinsäure, die symetrisch (=achiral) gebaut und daher optisch inaktiv ist.
Die Mesoweinsäure verhält sich zur D-Weinsäure (und ebenso zur L-Weinsäure) nicht wie Bild und Spiegelbild. Beide sind zueinander nicht enantiomer, sondern diastereomer.
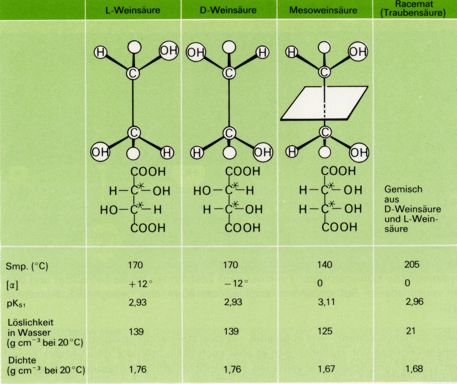
Wie die Werte der Abbildung zeigen, unterscheiden sich Diastereomere deutlich in ihren physikalischen und chemischen Eigenschaften. Die achirale und daher optisch inaktive Mesoweinsäure ist zudem klar zu unterscheiden von dem ebenfalls optisch inaktiven Gemisch aus gleichen Mengen der beiden enantiomereren Weinsäuren (D- und L-Weinsäure), das als Traubensäure bekannt ist.
Nach ihr werden allgemein äquimolare Gemische von zwei Enantiomeren als Racemeate (racemus [lat.] = Traube) bezeichnet.
Das Beispiel der Mesoweinsäure zeigt, das Moleküle mit asymetrischen Kohlenstoffatomen keineswegs immer chiral gebaut (und damit optisch aktiv) sein müssen. Andererseits ist die Molekülchiralität auch ohne asymetrisches Kohlenstoffatom möglich.
Dafür finden wir Beispiele bei unsymetrisch substituierten Allenen:
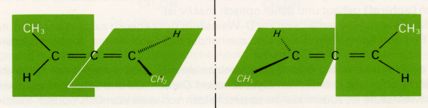
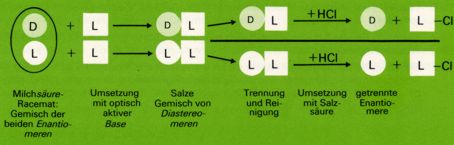
Die Trennung (Spaltung) von Racematen geschieht meist dadurch, dass man sie mit einer optisch aktiven Verbindung reagieren lässt. Die beiden Produkte einer solchen Reaktion sind zwar stereoisomer, aber nicht spiegelbildlich zueinander. Sie sind Diastereomere und unterscheiden sich daher in ihren physikalischen Eigenschaften, wie Löslichkeit, Schmelz- u. Siedepunkt usw. Nach ihrer Trennung werden die Produkte zerlegt und die optisch aktiven Komponenten des ursprünglichen Racemats in reiner Form erhalten. Die wichtigsten und am häufigsten angewandten Methoden bestehen in der Bildung von Salzen mit optisch aktiven Säuren bzw. Basen (welche als reine Enantiomere in der Natur vorkommen; z.b. pflanzliche Aminosäuren).