 Bei den Phenolen sind Hydroxylgruppen direkt an Benzolkerne gebunden.
Bei den Phenolen sind Hydroxylgruppen direkt an Benzolkerne gebunden.| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
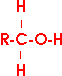 Die vom Wort Alkohol abgeleitete
Endung -ol kennzeichnet eine organische Verbindung als Alkohol, die Bezeichnung Alkanol
für gesättigte Alkohole weist auf die Herleitung von den Alkanen hin.
Die vom Wort Alkohol abgeleitete
Endung -ol kennzeichnet eine organische Verbindung als Alkohol, die Bezeichnung Alkanol
für gesättigte Alkohole weist auf die Herleitung von den Alkanen hin.
 Bei den Phenolen sind Hydroxylgruppen direkt an Benzolkerne gebunden.
Bei den Phenolen sind Hydroxylgruppen direkt an Benzolkerne gebunden.
Beweisend für die Struktur der Alkohole als Derivate des Wassers (ein Wasserstoffatom ist durch einen organischen Rest ersetzt) ist z.B. ihre Herstellung aus Halogenderivaten von Kohlenwasserstoffen:
Im Verlauf dieser Reaktion wird ein Halogenatom durch eine Hydroxylgruppe ersetzt. Die substituierend
wirkenden teilchen sind Hydroxidionen; es muß sich also um eine polare Reaktion handeln.
Da die C-Halogen-Bindung polar ist, besitzt das Kohlenstoffatom eine geringe positive Überschußladung.
Trifft nun ein Hydroxidion "von hinten" auf dieses Kohlenstoffatom, so kann sich die C-Br-Bindung
lockern, während sich eine neue C-O-Bindung auszubilden beginnt. In einem bestimmten Zeitpunkt muß
die C-Br-Bindung schon stark gedehnt , die C-O-Bindung aber noch nicht ganz gebildet sein; das Bromatom
ist dann noch nicht völlig abgetrennt. Löst sich nun das Bromidion von diesem aktivierten Komplex
ab, so hat ein Ersatz des Bromatoms durch die Hydroxylgruppe stattgefunden:
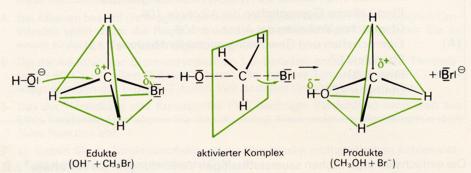
Im Verlaufe dieser Sustitution tritt also ein Umklappen der C-H-Bindungen ein, ähnlich dem Umkehren eines Regenschirmes. Im aktivierten Komplex stehen die drei Wasserstoffatome mit dem Kohlenstoffatom in einer Ebene.
Die Bildung von Alkoholen durch Reaktionen von Halogeniden mit Hydroxidionen ist ein Beispiel für einen
bei organischen Verbindungen häufigen Reaktionstyp:
die nucleophile Substitution (SN-Reaktion). Eine Vorraussetzung dafür, dass an
einer Verbindung eine solche Substitution durchgeführt werden kann, ist, dass die Bindung zwischen dem
Kohlenstoffatom und dem mit ihm verbundenen austretenden Atom polar ist, wobei das Kohlenstoffatom
positiv polarisiert sein muß. C-H-Bindungen von Kohlenwasserstoffen reagieren deshalb nicht mit Nucleophilen .
Je nach der Stellung der Hydroxylgruppe unterscheidet man primäre, sekundäre und tertiäre Alkohole:
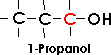 Bei primären Alkoholen ist die Hydroxylgruppe an ein primäres Kohlenstoffatom gebunden; für
sie ist die Gruppe CH2OH charakteristisch.
Bei primären Alkoholen ist die Hydroxylgruppe an ein primäres Kohlenstoffatom gebunden; für
sie ist die Gruppe CH2OH charakteristisch.
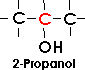 Bei sekundären Alkoholen ist die Hydroxylgruppe an ein sekundäres Kohlenstoffatom gebunden;
sie ist durch die Atomgruppe CHOH gekennzeichnet.
Bei sekundären Alkoholen ist die Hydroxylgruppe an ein sekundäres Kohlenstoffatom gebunden;
sie ist durch die Atomgruppe CHOH gekennzeichnet.
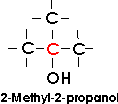 Bei tertiären Alkoholen ist die Hydroxylgruppe an ein tertiäres Kohlenstoffatom gebunden;
für sie ist die Gruppe COH kennzeichnend.
Bei tertiären Alkoholen ist die Hydroxylgruppe an ein tertiäres Kohlenstoffatom gebunden;
für sie ist die Gruppe COH kennzeichnend.
Die drei Alkoholtypen unterscheiden sich z.B. in ihrem Verhalten gegenüber Oxidationsmitteln; auch die Reaktionsgeschwindigkeit gewisser Reaktionen (Esterbildung) ist bei den verschiedenen Alkoholklassen sehr verschieden.
Alkohole mit mehreren Hydroxylgruppen werden mehrwertig genannt. Diese Hydroxylgruppen sind dabei stets an verschiedenen Kohlenstoffatomen gebunden; Verbindungen, die zwei oder drei Hydroxylgruppen an ein einziges Kohlenstoffatom gebunden enthalten, sind - mit wenigen Ausnahmen - nicht existenzfähig. Wenn bei einem Vorgang solche Verbindungen entstehen sollten, spalten die betreffenden Moleküle spontan Wasser ab.
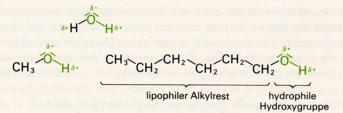
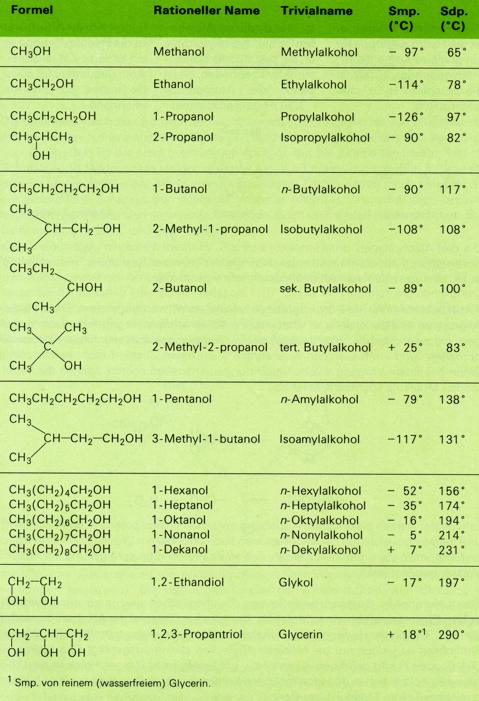
Die niedrigen Alkohole sind farblose, leicht bewegliche Flüssigkeiten von charakteristischem Geruch. Höhere Alkohole (C6 bis C11) sind dickflüssig. Dodekanol ("Laurylalkohol" C12H25OH) ist der erste geradkettige Alkohol, der bei Zimmertemperatur fest ist. Schmelz- und Siedepunkte steigen also wie bei den Kohlenwasserstoffen mit zuhnehmender Molekülmasse an. Alkohole mit verzweigten Ketten sieden meist tiefer als die entsprechenden geradkettigen Alkohole; manche Alkohole mit kompakten, beinahe kugelförmigen Molekülen schmelzen besonders hoch und sieden relativ tief (vgl. tertiäres Buthanol).
Schmelz- und Siedepunkte der Alkohole liegen im allgemeinen beträchtlich höher als bei den Kohlenwasserstoffen von entsprechender Molekülmasse. Methanol siedet bei 65°C, Ethan siedet bei -87°C. Die im Vergleich mit den Kohlenwasserstoffen verstärkten zwischenmolekularen Kräfte sind auf Wasserstoffbrücken zwischen den positiv polarisierten Wasserstoff- und den negativ polarisierten Sauerstoffatomen der Hydroxylgruppe zurückzuführen.
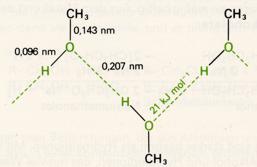
Im flüssigen Zustand sind die Alkoholmoleküle über Wasserstoffbrücken zu Ketten verbunden (assoziiert). Die "Bindungsenergie" der Wasserstoffbrücken-Bindungen ist zwar vergleichsweise gering, muß aber bei der Herstellung von Einzelmolekülen, also beim Übergang in den gasförmigen Zustand, aufgewendet werden. Daraus erklären sich die hohen Siedepunkte.
In Molekülen mit mehreren Hydroxylgruppen (z.B. Zucker) können die zwischenmolekularen Kräfte so groß werden,
dass das Molekül beim Erhitzen eher zerbricht und verkohlt, als zu schmelzen beginnt oder gar siedet.
Die Alkoholmoleküle vermögen auch mit Wassermolekülen Wasserstoffbrücken zu bilden. Mit steigender
Molekülmasse nehmen jedoch die Van der Waals-Kräfte zu und werden schließlich größer als die
Wirkung der Wasserstoffbrücken. Die gegnseitige Anziehung der Alkoholmoleküle wird dann stärker als
die Anziehung zwischen den Alkohol- und Wassermolekülen, und es bilden sich aus Alkohol und Wasser zwei
Phasen. Nur die Alkohole mit einem bis drei Kohlenstoffatome sowie tert. Butylalkohol mischen sich deshalb
in jedem Verhältnis mit Wasser; die Butanole (ausgenommen tert. Butylalkohol) sowie die Amylalkohole
(C5) lösen sich nur noch in beschränktem Maß in Wasser. In unpolaren Lösungsmitteln
lösen sich auch die niederen Alkohole (wenn sie wasserfrei sind). Methanol und Ethanol haben deshalb
als Lösungsmittel eine sehr starke Bedeutung.
Alkohole sind wie Wasser Protonenspender (Säuren) und Protonenempfänger (Basen):
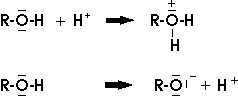
Die Alkohole sind aber schwächere Säuren und Basen als Wasser.
Mit Alkalimetallen reagieren sie mäßig heftig. Aus dem Metall und dem Alkohol entstehen dabei salzartige
Alkoholate:
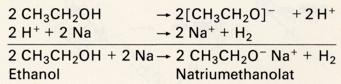
Die Alkoholat-Anionen sind stärker basisch als Hydroxidionen. Mit Wasser bildet sich ein Gleichgewicht mit Alkohol und Hydoxidionen, das mit viel Wasser auf die rechte Seite verschoben wird:
2. die Substitution der Hydroxyl-Gruppe
Die C-O-Bindung des die Hydroxylgruppe tragenden Kohlenstoffatoms ist zwar stärker polar als die C-H-Bindung
in Kohlenwasserstoffen, jedoch genügt die Polarität nicht, um z.B. in Lösung die Abspaltung der Hydroxylgruppe
als Hydroxidion zu ermöglichen. Auch die direkte Substitution der Hydroxylgruppe durch ein nucleophiles
Teilchen ist nicht möglich, weil das dabei auftretende Hydroxidionen selbst stark nucleophil ist.
Arbeitet man dagegen in stark sauren Lösungen, so wird das Alkoholmolekül protoniert. An das freie
Elektronenpaar des negativ polarisierten Sauerstoffatoms lagert sich ein Proton an und es entsteht ein
Oxoniumion. Dies kann bei bestimmten Reaktionen wieder das Proton abgeben, also als Säure
wirken: Das Oxonium ist die konjugierte Säure des Alkoholmoleküls.
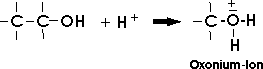
Wird dieses Oxonium durch ein Nucleophil (N-) angegriffen, so tritt das (verglichen mit dem Hydroxidion) sehr viel schwächer nucleophile Wassermolekül als "Abgangsgruppe" aus: Die nucleophile Substitution wird möglich. SN-Reaktionen mit Alkoholen verlaufen daher nur in stark saurer Lösung.
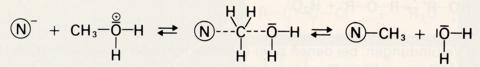
Beispiele für nucleophile Substitutionen der Hydroxylgruppe sind:
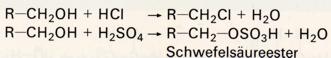
3. Reaktionen mit Halogenwasserstoff und starken Säuren: Esterbildung
Die praktisch wichtigste SN-Reaktion an Alkoholen ist die Bildung von Halogeniden aus Alkohol und Halogenwasserstoff (bzw. einem Gemisch von Alkalihalogenid und konz. Schwefelsäure). Hier ist das Nucleophil (N-) ein Halogenidion. Andere starke Säuren wie konz. Schwefelsäure oder Salpetersäure reagieren ähnlich; ihre Anionen wirken (bei RT) dann als Nucleophile, und es bildet sich ein sogenannter Ester:
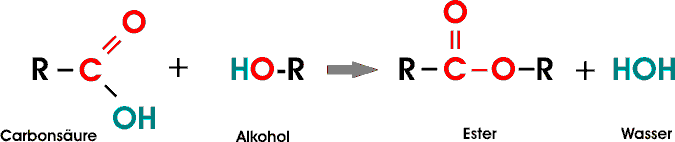
Als Ester bezeichnet man Verbindungen, die aus Alkoholen und Säuren unter Abspaltung von Wasser, also in einer Kondensationsreaktion, erhalten werden können.
Eine typische organische Reaktion ist die Esterbildung durch einen Alkohol (ein oder mehrwertig) und eine (oder mehrere) Carbonsäuren:
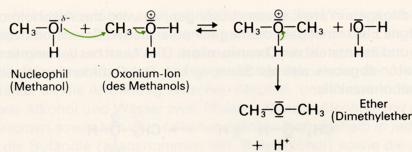
4. Reaktion mit Alkohol: Etherbildung
Läßt man zu einem erhitzten Gemisch von Alkohol und starker Säure fortwährend weiteren Alkohol hinzutropfen, so reagieren die jetzt im Überschuß vorhandenen Alkoholmoleküle als sustituierend wirkende nucleophile Teilchen, und es entsteht ein Ether:
Die Gesamtgleichung der Reaktion lautet:
oder allgemein:
Ether sind Verbindungen, bei denen zwei (gleichartige oder verschiedene) Alkylgruppen über eine Sauerstoffbrücke verbunden sind (R-O-R bzw. R-O-R').
Eine praktisch wichtige Reaktion ist die bereits erwähnte Elimination (Abspaltung) von Wasser, wobei
ungesättigte Verbindungen entstehen. Sie geht ebenfalls unter der Wirkung starker Säuren vor sich
(die den Alkohol zuerst protonieren -> Oxoniumion).
Primäre Alkohole erfordern Reaktionstemperaturen um 180°C und einen Zusatz von Quarzsand oder geglühtem
Aluminiumsulfat als Katalysator, während sekundäre Alkohole bereits bei etwa 130°C, tertiäre Alkohole bei
noch niedrigeren Temperaturen reagieren.
Bei der Elimination von Wasser wird vom Oxoniumion des Alkohols zuerst ein Molekül Wasser abgespalten:
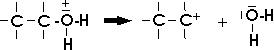
Das gebildete Carbeniumion stabilisiert sich durch die Abspaltung eines Protons:
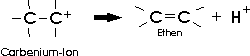
Von den beiden Reaktionsschritten ist die Abspaltung des Wassers (also die Bildung des Carbeniumions) die langsamere; sie ist also geschwindigkeitsbestimmend. Die Tatsache, dass die Elimination vom primären zum sekundären und zum tertiären Alkohol immer leichter wird, weist darauf hin, dass tertiäre Carbeniumionen stabiler als sekundäre und diese stabiler als primäre sind.
6. Oxidation Beim Erhitzen an der Luft verbrennen Alkohole zu Kohlendioxid und Wasser. Ihre Verbrennungswärmen sind allerdings geringer als bei entsprechenden Kohlenwasserstoffe, weil sie - verglichen mit diesen - bereits einen höheren oxidierten Zustand darstellen. Durch Kaliumpermanganat (KMnO4), Kaliumdichromat (K2Cr2O7) oder andere Oxidationsmittel lassen sich Alkohole auch zu anderen sauerstoffhaltigen Produkten oxidieren. Je nach Stellung der Hydroxylgruppe im Alkoholmolekül erhält man verschiedene Produkte.
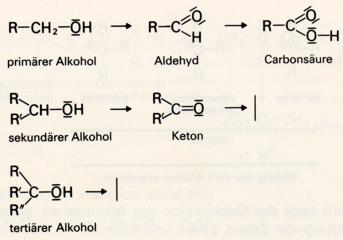
Bei schonender Durchführung der Reaktion läßt sich ein primärer Alkohol stufenweise oxidieren, indem das zunächst entstehende Produkt, das Aldehyd noch weiter zu einer Carbonsäure oxidiert werden kann. Aldehyde wirken daher reduzierend.
Ketone, die Oxidationsprodukte sekundärer Alkohole, lassen sich unter vergleichbaren Bedingungen nicht mehr weiter oxidieren; die Anwendung stärkerer Oxidationsmittel oder stärkeres Erhitzen führt in gewissen Fällen zu Peroxiden (mit der Gruppe -O-O-) und schließlich zum Abbau des Moleküls.
Wie die Ketone lassen sich auch die tertiären Alkohole nur durch ganz besondere kräftige Oxidationsmittel oxidieren, wobei im Endeffekt das Molekül ebenfalls abgebaut wird.
Durch ihr Verhalten gegenüber Oxidationsmittel lassen sich deshalb primäre, sekundäre und tertiäre Alkohole leicht unterscheiden.
Die C=O-Gruppe ist ebenfalls zur Additionsreaktion befähigt, wobei meistens der erste Reaktionsschritt
in der Addition eines nucleophilen Teilchens an das Kohlenstoffatom der Carbonylgruppe besteht (AN-Reaktion).
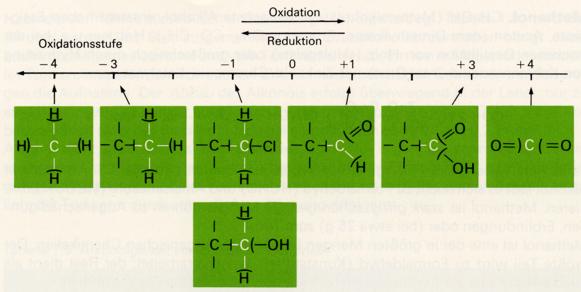
Der Oxidationszustand eines Kohlenstoffatoms kann durch einen Hilfsbegriff, die Oxidationszahl
oder Oxidationsstufe, beschrieben werden.
Zur Ermittlung der Oxidationszahl werden die Elektronenpaarbindungen in Gedanken zerlegt: C-C-Bindungen
werden homolytisch getrennt (jedem Partner die Hälfte der bindenden Elektronen zugeordnet). Bei polaren
Bindungen (C-H, C-Hal, C-OH, C=O) werden die bindenden Elektronen dem elektronegativeren Partner
zugerechnet. Die beim Vergleich mit dem isolierten Kohlenstoffatom mit seinen vier Valenzelektronen
auftretende Ladung wird als Oxidationszahl bezeichnet.
Beim Methan (CH4) sind nach diesen Regeln dem Kohlenstoffatom acht Elektronen zuzuordnen. Gegenüber
dem isolierten Atom (mit vier Valenzelektronen) besitzt er somit vier negative Ladungen zuviel und hat die
Oxidationsstufe -4. Die Oxidationsstufen des Kohlenstoffs in Verbindungen liegen somit zwischen
-4 und +4.
Methanol, CH3OH (Methylakohol), der einfachste Alkohol, entsteht neben Essigsäure,
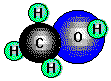 Aceton, Holzteer u.a. bei der trockenen Destillation von Holz oder großtechnisch durch Hydrierung von
Kohlenmonoxid unter Druck mit Zinkoxid/Chromoxid-Katalysatoren:
Aceton, Holzteer u.a. bei der trockenen Destillation von Holz oder großtechnisch durch Hydrierung von
Kohlenmonoxid unter Druck mit Zinkoxid/Chromoxid-Katalysatoren:
Es ist eine wasserklare Flüssigkeit von typischem Geruch (Sdp. 65°C). Als primärer Alkohol läßt es sich leicht zu Formaldehyd (HCHO) und Ameisensäure (HCOOH) oxidieren. Methanol ist stark giftig; schon geringe Mengen führen zu Augenschädigungen, Erblindungen oder (bei etwa 25g) zum Tod.
Ethanol, CH3CH2OH (Ethylalkohol) wird synthetisch aus Ethen gewonnen:
Ein Teil wird durch Vergärung von Traubenzucker durch Hefe erhalten, als Endprodukt der Traubenzuckergärung entstehen
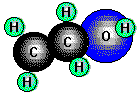 Alkohol und Kohlendioxid:
Alkohol und Kohlendioxid:
Ethanol, eine wasserklare Flüssigkeit von charakteristischem Geruch siedet bei 78,3°C. Die Dichte (0,79g/ml) nimmt mit zunehmender Verdünnung zu. Ein großer Teil Ethanol wird zu Acetaldehyd (CH3CHO) und Essigsäure (CH3COOH) oxidiert. Technischer Alkohol wird durch Zusatz von 1 - 2% Benzol, Aceton, Pyridin oder Campher "vergällt" oder "denaturiert", d.h. ungenießbar gemacht.
Höhere Alkohole: Amylalkohole (Pentanole), ölige Flüssigkeiten mit unangenehmem, zum Husten
reizenden Geruch, entstehen als Nebenprodukte der alkoholischen Gärung aus Eiweißen. Sie dienen zur
Herstellung von Riechstoffen und als Lösungsmittel und wirken stärker giftig als Ethanol.
Längerkettige Alkohole treten als Ester in vielen pflanzlichen Wachsen und im Walrat auf.
Natriumsalze der Schwefelsäureester höherer Alkohole haben als Waschmittel Bedeutung erlangt.
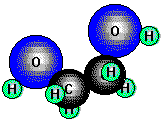 Glykol (Ethandiol) ist der einfachste Alkohol mit zwei Hydroxylgruppen (ein zweiwertiger Alkohol).
Er ist eine farblose, dickliche Flüssigkeit von schwach süßem Geschmack und wird z.B. als Frostschutzmittel
für Motorkühler verwendet.
Glykol (Ethandiol) ist der einfachste Alkohol mit zwei Hydroxylgruppen (ein zweiwertiger Alkohol).
Er ist eine farblose, dickliche Flüssigkeit von schwach süßem Geschmack und wird z.B. als Frostschutzmittel
für Motorkühler verwendet.
Glycerin, Glycerol (1, 2, 3-Propantriol), ist ein dreiwertiger Alkohol und
enthält zwei primäre und eine sekundäre Hydroxylgruppe. Die zähflüssige, ebenfalls süße Flüssigkeit siedet auffallend hoch
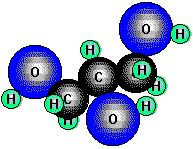 (290°C) und mischt sich in jedem Verhältnis mit Wasser. Glycerin kommt als Ester von höheren Carbonsäuren
in der Natur vor (Fette und Öle). Man gewinnt es aus Fetten; eine technische Synthese geht auch von dem
in Crackgasen vorhandenen Propen aus:
(290°C) und mischt sich in jedem Verhältnis mit Wasser. Glycerin kommt als Ester von höheren Carbonsäuren
in der Natur vor (Fette und Öle). Man gewinnt es aus Fetten; eine technische Synthese geht auch von dem
in Crackgasen vorhandenen Propen aus:
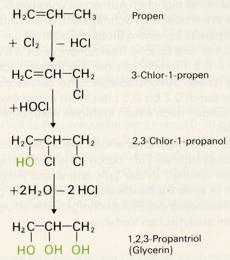
Bei hoher Temperatur entsteht aus Propen und Chlor das Substitutionsprodukt 3-Chlor-1-propen. Durch Addition von unterchloriger Säure (HOCl) wird 2, 3-Dichlor-1-propanol hergestellt und dieses mit verdünnter Lauge zum 1, 2, 3-Propantriol umgesetzt.
Glycerin wird ebenfalls als Frostschutzmittel sowie in der Pharmazie (z.B. in Salbengrundlagen und als Lösunsmittel) verwendet; ein großer Teil des technischen Glycerins dient zur Herstellung von Glycerintrinitrat:
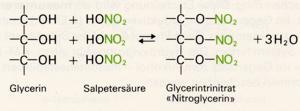
Der Salpetersäureester des Glycerins, das Glycerintrinitrat, wird fälschlicherweise meist Nitroglycerin genannt, enthält aber nicht die Nitroverbindungen kennzeichnende Gruppierung -C-NO2. Er ist einer der wichtigsten Sprengstoffe. Die farblose, schwere, ölige Flüssigkeit bildet sich aus Glycerin und konz. Salpetersäure und zersetzt sich auf Schlag (auch auf Erschütterung) oder bei geringem Erwärmen mit äußerster Heftigkeit. Es entstehen dabei lauter gasförmige Produkte:
Zur praktischen Verwendung wird es in Kieselgur aufgesaugt (Dynamit) oder mit Nitrocellulose gelantiniert.
Verbindungen, welche Hydroxylgruppen direkt an einem Benzolring gebunden enthalten, heißen Phenole.
Das Phenol, C6H5OH, hat der ganzen Gruppe den Namen gegeben.
Phenole regieren stärker sauer als Alkohole, so dass bereits die wäßrige Phenollösung eine Indikatorlösung
umfärbt. Das Gleichgewicht
kann durch Zugabe von Laugen auf die Seite des Phenolations, aber bereits durch schwache Säuren (z.B. Kohlensäure)
auf die Seite des Phenols verschoben werden (Ausscheidung des in Wasser wenig löslichen Phenols). Der
Grund für dieses von den Alkoholen abweichenden Verhaltens liegt darin, dass der aromatische Ring
die Polarität der Hydroxylgruppe verstärkt.
Phenol reagiert sehr heftig mit Brom oder mit Salpetersäure, wobei drei Wasserstoffatome substituiert werden:
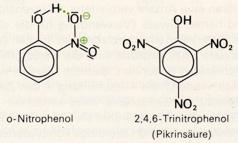
Das o-Nitrophenol ist schlechter wasserlöslich (und flüchtiger) als das Phenol, da es zur Ausbildung einer Wasserstoffbrücke zwischen der Hydroxylgruppe und der Nitrogruppe kommt und dadurch die Wechselwirkung mit den Wassermolekülen erschwert ist. Aufgrund der elektronenanziehenden Wirkung der Nitrogruppe wird die Abspaltung des Protons von der Hydroxylgruppe erleichtert und die Acidität gesteigert. Trinitrophenol (Pikrinsäure) ist daher eine ziemlich starke Säure.
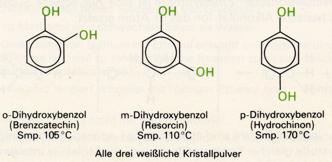
Die drei isomeren Dihydroxybenzole, Brenzkatechin, Resorcin und Hydrochinon, können aus dem Steinkohleteer isoliert werden.
Manche mehrwertigen Phenole lassen sich leicht oxidieren. Dabei entsteht aus dem 1, 3-Dihydoxyphenol (Hydrochinon) das Chinon:
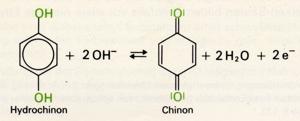
Darauf beruht die Verwendung des Hydrochinon als Entwickler im fotografischen Prozeß, sowie die wichtige Eigenschaft, bei
der Photosynthese als Elektronencarrier zu fungieren.
Zu den Phenolen gehören eine Anzahl verbreiteter Pflanzenstoffe. Die Gerbstoffe fällen Leimlösungen
und härten Eiweiß und sind durch bitteren, herben Geschmack ausgezeichnet. Wie auch viele andere
Pflanzenstoffe sind die Gerbstoffe in der Pflanze an bestimmten Zuckerarten chemisch gebunden; dadurch
werden wasserunlösliche Moleküle häufig wasserlöslich, wodurch die Ausscheidung in den Zellsaft ermöglicht wird.
Auch die gelben, roten und blauen Blütenfarbstoffe sind Phenole. Gewisse Phenolverbindungen treten als
Riech- oder Aromastoffe auf: Etwa das Vanillin in der Vanilleschote oder das Thymol im Thymian, u.a..
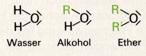
Wie die Alkohole können auch die Ether als derivate des Wassers aufgefaßt werden. Dabei sind aber beide Wasserstoffatome durch Kohlenwasserstoffreste ersetzt:
Ether können durch Einwirkung starker Säuren auf Alkohole oder auch aus Alkoholaten und Halogenalkanen entstehen:
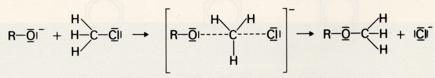
Diese Williamsonsche Ethersynthese ist auch eine nucleophile Substitution, wobei das stark basische Alkoholation das Cl-Atom ersetzt:
Die Ether mit niedriger C-Zahl sind stark flüchtig und sieden nur wenig höher als die Kohlenwasserstoffe gleicher Kohlenstoffzahl, weil die Moleküle infolge des am Sauerstoffatom fehlenden Wasserstoffatoms nicht assoziieren. Hingegen können die freien Elektronenpaare des Sauerstoffatoms Wasserstoffbrücken mit Wasser- oder Alkoholmolekülen bilden; die Löslichkeit der niedrigen Ether in Wasser sind fast gleich groß wie die der Alkohole von gleicher Kohlenstoffzahl. Mit starken Säuren bilden ebenfalls vor allem niedrige Ether wasserlösliche Oxoniumsalze:
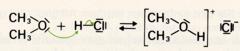
Ethylether (genauer Diethylether C2H5-O-C2H5), der wichtigste Ether, wird aus Ethanol mit konz. Schwefelsäure hergestellt. Er ist ein wichtiges Lösungsmittel; seine Nachteile sind die leichte Entzündbarkeit seiner Dämpfe sowie die explosiven Peroxide, die sich beim Stehenlassen an der Luft bilden können. In der Medizin wurde er lange Zeit als Narkosemittel verwendet. Heutzutage wird er aufgrund seiner Giftigkeit durch andere Mittel ersetzt, in der Kriminal-Literatur findet man ihn jedoch noch häufig.