| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Während zur Herstellung von Nitrobenzol konzentrierte Salpetersäure und konzentrierte Schwefelsäure bei 60°C einwirken müssen, gelingt
die Nitrierung von Phenol bereits mit 25 %iger Salpetersäure bei RT.
Eine derartige Aktivierung des aromatischen Ringes bewirken neben der Hydroxylgruppe auch die Methylgruppe (Methylbenzol, Toluol)
und die Aminogruppe (Anilin).
Umgekehrt verringert die Nitrogruppe die Neigung zu einer Zweitsubstitution. Nitrobenzol lässt sich nur mit einem Gemisch aus rauchender
Salpetersäure und konzentrierter Schwefelsäure und bei Temperaturen von über 90°C weiter nitrieren.
Die Nitrogruppe (-NO2), aber auch die Gruppen –CN, -SO3H, -CHO, -COOH und –Halogene desaktivieren
den aromatischen Ring.
Erstsubstituenten verändern nicht nur die Reaktivität. Sie bewirken zudem, dass der Zweitsubstituent in einer ganz bestimmten Orientierung zum Erstsubstituenten eingebaut wird.
Während sich bei einer gleich häufigen Substitution an allen fünf zur Verfügung stehenden Positionen des Ausgangsstoffes C6H5-X das Produkt zu je 2/5 aus dem ortho- und dem meta-Isomeren und zu 1/5 aus dem para-Isomeren zusammensetzen müsste, ist das tatsächliche Reaktionsverhalten ganz anders.
Es gibt Erstsubstituenten (-OH, -CH3, -Halogene), die den Zweitsubstituenten bevorzugt in o- und p- Stellung dirigieren, und Substituenten (-NO2, -CN, -SO3H. -CHO, -COOH), die eine weitere Substitution in m- Stellung begünstigen.
|
aktivierend |
ortho-, para- dirigierend |
-OH, -CH3, -NH2 |
|
desaktivierend |
meta- dirigierend ortho-, para- dirigierend |
-NO2,
-CN, -SO3H, -CHO, -COOH -Halogene |
Auftreten von ortho-, meta-, para- Isomeren bei der Nitrierung eines bereits substituierten Benzols:
|
|
ortho- (%) |
para- (%) |
Summe o- + p- |
meta- (%) |
|
-OH |
~50 |
~50 |
100% |
Spuren |
|
-CH3 |
59 |
37 |
96 |
4 |
|
-Cl |
30 |
70 |
100 |
Spuren |
|
-Br |
37 |
62 |
99 |
1 |
|
-NO2 |
6 |
< 1 |
7 |
93 |
|
-CN |
|
|
19 |
81 |
|
-SO3H |
21 |
7 |
28 |
72 |
|
-CHO |
|
|
28 |
72 |
|
-COOH |
19 |
1 |
20 |
80 |
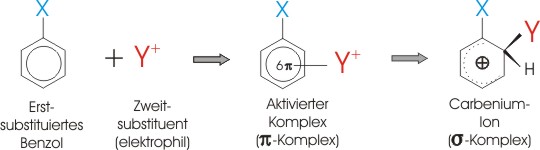
Über die Reaktivität entscheidet daher wie leicht sich der pi-Komplex bildet.
Wird dieser aktivierte Komplex durch einen Substituenten stabilisiert und somit die notwendige
Aktivierungsenergie verringert, so nimmt die Reaktivität zu.
Da die Energien der aktivierten Komplexe aber nur schwer abzuschätzen sind, verwendet man meist die
Energien der Zwischenstoffe (Carbeniumionen), die nahe an den Energien der Übergangszustände liegen.
Das stabilste Carbeniumion erfordert zu seiner Bildung die geringste Aktivierungsenergie.

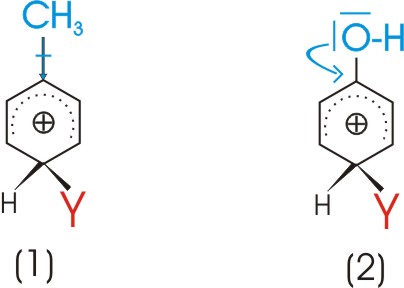
Stabilisierung durch Elektronendonatoren:
Das Carbeniumion ist umso stabiler, je mehr seine positive Ladung abgeschwächt wird. Eine Verringerung
der positiven Ladung des Ions kann durch einen elektronenliefernden Erstsubstituenten
(blau) bewirkt werden.
Als Elektronendonatoren sind möglich:
1) Substituenten mit einem positiven induktiven Effekt (+I-Effekt), die die gemeinsame Elektronenwolke zum Ring verschieben
2) Substituenten mit einem positiven Mesomerieeffekt (+M-Effekt), die ein freies Elektronenpaar dem Ring zur Verfügung stellen.
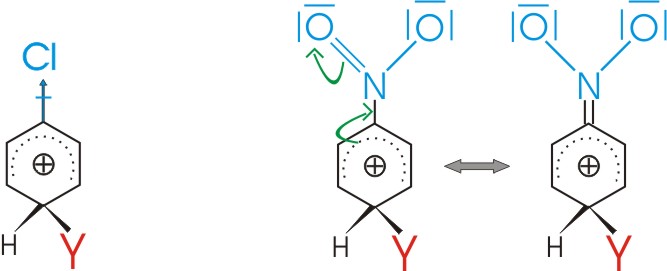
Erschwerte Bildung durch Elektronenakzeptoren:
Umgekehrt wird ein Substituent mit negativ induktivem Effekt (-I-Effekt) oder mit einem negativen Mesomerieeffekt (-M-Effekt) die positive Ladung des Carbeniumions noch erhöhen und damit eine weitere Substitution erschweren (Elektronenakzeptoren):
Es werden hauptsächlich diejenigen Vorgänge ablaufen, die die geringste Aktivierungsenergie benötigen.
Ein sigma-Komplex (Carbeniumion) ist umso stabiler (= niedrigste Energie), je mehr positive Ladungen
delokalisiert sind.
Um die dirigierende Wirkung von Substituenten zu verstehen, muss man ihren Einfluss auf die bei
o-, m- und p- Substitution gebildeten Carbeniumionen betrachten.
Ohne Erstsubstitution lässt sich das Carbeniumion durch folgende Grenzformeln veranschaulichen:
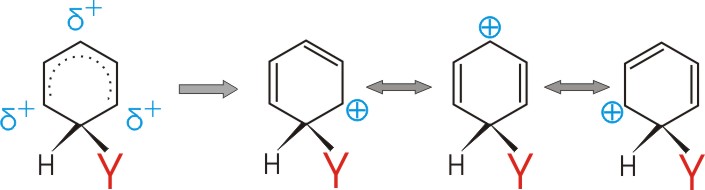
In o- und p- Stellung zum neu eintretenden (Zweit-)Substituenten (Y) treten positive Partialladungen auf.
In m-Stellung befindet sich keine positive Partialladung!!!!!
Diese Ladungsverteilung wird durch verschiedenen Erstsubstituenten (X) in unterschiedlicher Weise beeinflusst:
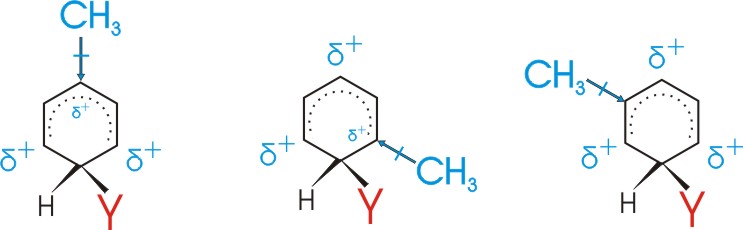
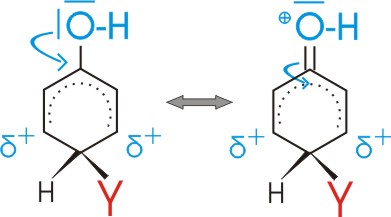
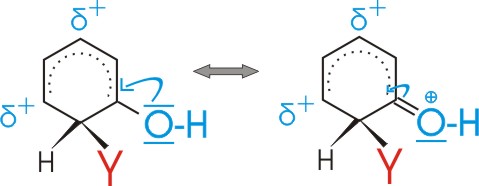
Substituenten mit +I oder +M Effekt erniedrigen also die Energie des sigma-Komplexes für den Fall der o- und p- Substitution
--> o- und p- Substitutionsprodukte bilden sich daher schneller.
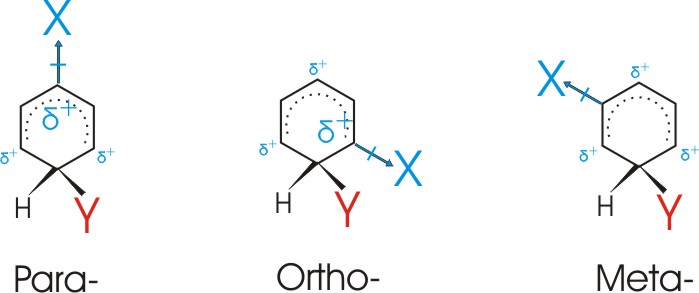
Hier sind sowohl –I als auch +M Effekt wirksam.
Als Folge des –I Effekts ist die Substitutionsgeschwindigkeit erniedrigt, er reicht allerdings nicht aus, um den
+M Effekt zu kompensieren.
|
Erstsubstituent mit |
Wirkung auf
Zweitsubstituenten |
Dirigieren des
Zweitsubstituenten |
Beispiele |
|
+M |
aktivierend |
o- und p- Stellung |
-OH, -OCH3, -HN2 |
|
+I |
(weniger) aktivierend |
o- und p- Stellung |
-CH3, -Alkylrest |
|
-M oder –I |
desaktivierend |
m- Stellung |
-NO2, -COH, -COOH |
|
-I und +M |
desaktivierend (wegen –I) |
o- und p- Stellung (wegen +M) |
-Halogene |