| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|

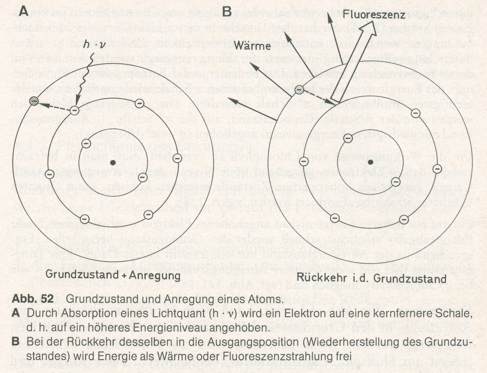
In einem Atom oder Molekül verteilen sich die Elektronen auf einzelnen Schalen, die in verschiedenen Abständen um den Atomkern angeordnet sind. Die Elektronen in der Nähe des Kerns besitzen relativ niedrige Energie, die von ihm am weitesten entfernten eine vergleichsweise hohe. Die Verlagerung eines Elektrons von einer kernnahen auf eine kernfernere Schale erfordert die Zufuhr eines bestimmten Energiebetrags, denn es wird ein negativ geladenes Teilchen (Elektron) von dem stark positiven Kern fortbewegt. Dieses Ereigniss tritt ein, wenn das Atom von einem Photon getroffen wird, dessen Energie genau ausreicht, das Elektron auf eine äußere Schale und damit auf ein höheres Energieniveau zu heben.
Das betroffenen Atom wird dadurch aus dem Grundzustand in einen Anregungszustand überführt. Dass ein Atom nur die Strahlung einiger bestimmter Wellenlängen absorbiert, findet hier seine Erklärung. Nur ihre Quanten besitzen die Energie, die zur Überwindung der Energiedifferenz zwischen dem Grundzustand und einem Anregungszustand gerade ausreicht. Die Strahlungsenergie eines Quant kann nur als Ganzes, nicht aber in Bruchteilen genutzt werden. Da nur die Quanten einer Wellemlänge an jeder Elektronenverschiebung im Atom beteiligt sind, ist eine Absorptionslinie zu beobachten. Entsprechend umfassen die Absorptionsspektren von Atomen gewöhnlich nur wenige Linien.
Bei Molekülen verbreitern sich die Absorptionslinien der Atome zu Absorptionsbanden, das heißt zu einer Gruppe von Übergängen. Sie resultieren aus der zusätzlichen Anregung von Rotation und Vibration, welche mit dem Elektronenübergang im vielatomigen Molekül in enger Beziehung stehen. Die dafür erforderliche Energie liefert ebenfalls ein absorbiertes Quant.
Gesättigte organische Verbindungen absorbieren im allgemeinen ultraviolette Strahlung und erscheinen daher in unseren Augen farblos. Sind jedoch Chromophore wie:
vorhanden und stehen diese in Konjugation (regelmäßiges Aufeinanderfolgen von Einzel- und Doppelbindungen), dann verschiebt
sich die Absorption zu längeren Wellenlängen, d.h. in den sichtbaren Bereich des Spektrums: die Verbindung ist mehr oder
weniger intensiv gefärbt.
Die selektive Lichtabsorption durch Pigmentmoleküle beruht auf einer Häufung von Chromophoren im konjugierten System.
Sie hat ihre Ursache in den Pi-Elektronen der Mehrfachbindungen, welche mit zuhnehmender Beweglichkeit (abhängig von der Größe
des Systems) schon durch langwellige ("energiearme") Strahlung angeregt werden können und damit Farbvertiefung bewirken.
Ein auf ein höheres Energieniveau angehobenes Elektron wird versuchen, unter Energieabgabe möglichst schnell wieder seinen Grundzustand herzustellen. Entsprechend ist der Anregungszustand nur von kurzer Dauer.