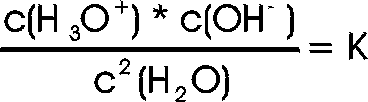
| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
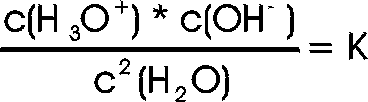
Das Gleichgewicht liegt weitgehend auf der linken Seite. K hat einen sehr kleinen Zahlenwert. In reinem Wasser wie auch in verdünnten Lösungen kann die Konzentration der H2O-Moleküle als konstant angesehen werden (sie sind gegenüber dem gelösten Stoff „unendlich" höher konzentriert). Ein Liter Wasser enthält 55,55 mol Moleküle (55,55 * 6,02*1023 H2O-Teilchen). Da die Konzentration des Wassers konstant ist, kann es in die Gleichgewichtskonstante einbezogen werden. Der Einfachheit halber verwenden wir außerdem die übliche Schreibweise H+ an Stelle von H3O+:
Diese Gleichung wird das Ionenprodukt des Wassers genannt. Bei 25°C hat es den Zahlenwert Kw = 1,0 * 10-14 mol2/l2. In reinem Wasser entstehen H+- und OH--Ionen zu gleichen Teilen, c(H+) = c(OH-); es gilt deshalb
Wird eine Säure in Wasser gelöst, so ist die H+-Ionen-Konzentration größer als 10-7
mol/l und die OH--Ionen-Konzentration kleiner als 10-7 mol/l. Man spricht von einer
sauren Lösung. Umgekehrt ist in einer basischen Lösung
c(OH-) > 10-7 und c(H+) < 10-7 mol/l.
Um nicht immer mit Potenzzahlen umgehen zu müssen, ist es zweckmäßig, logarithmische Größen einzuführen. Es wird der pH-Wert und der pOH-Wert als der negative Zehnerlogarithmus von c(H+) und c(OH-) definiert.
Für reines Wasser ist pH = 7; Lösungen die einen pH-Wert von 7 haben, werden neutral genannt. In sauren Lösungen ist der pH-Wert kleiner als 7; in basischen Lösungen gilt pH > 7. Eine pH-Wert-Erniedrigung um eine Einheit bedeutet eine Verzehnfachung der H+-Ionen-Konzentration.
Logarithmisch formuliert, lautet das Ionenprodukt des Wassers:
wobei auch für die Konstante Kw der negative Logarithmus verwendet wurde:
pKw = -log Kw
Für die Dissoziation von Essigsäure in wässriger Lösung läßt sich das Massenwirkungsgesetz anwenden
CH3COOH + H2O <--> H3O+ + CH3COO-
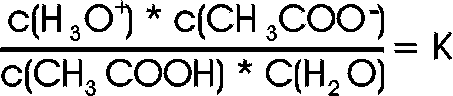
In verdünnter Lösung kann die Konzentration des Wassers als konstant angesehen werden. Dadurch können wir die konstante Größe in die Gleichgewichtskonstante mit einbeziehen (s.o. Ionenprodukt Wasser).
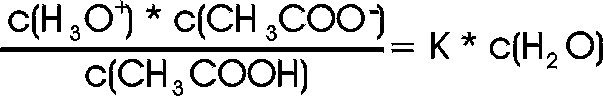
Dieses Produkt, K * c(H2O), wird Säuredissoziationskonstante Ks genannt.
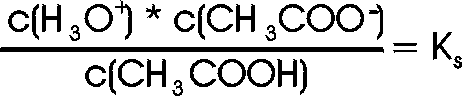
Der Einfachheit halber verwenden wir wieder die Bezeichnung c(H+); das so formulierte Massenwirkungsgesetz entspricht der vereinfachten Reaktionsgleichung, in der Wasser nicht vorkommt:
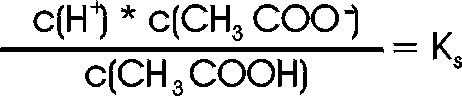
Bei Säuredissoziationsgleichgewichten stehen konventionsgemäß die H+-Ionen auf der rechten Seite der Reaktionsgleichung und somit im Zähler des MWG's (oben).
Mit Hilfe des MWG lassen sich die Konzentrationen der beteiligten Teilchen genau berechnen, wenn man für eine Reaktion die beteiligten Stoffmengen exakt abwiegt.
In wässrigen Lösungen von schwachen Basen stellt sich ebenfalls ein Gleichgewicht ein, an dem OH--Ionen beteiligt sind. Die zugehörige Gleichgewichtskonstante wird KB genannt (Basenkonstante).
Die Konstanten KS und KB sind ein Maß für die Säure- bzw. Basenstärke. Je größer der Zahlenwert von KS oder KB, desto stärker ist die Säure bzw. Base. Je kleiner der Wert von pKS desto stärker die Säure bzw. Base.
Indikatoren sind schwache Säuren. Dank ihrer intensiven Farbe werden nur wenige Tropfen einer verdünnten Indikatorlösung benötigt; der Zusatz des Indikators zur Probenlösung beeinflußt deshalb deren pH-Wert nur geringfügig.
Ein undissoziiertes Indikatormolekül, HInd, hat eine andere Farbe als seine konjugierte Base, Ind-.
Das Lackmus-Molekül ist zum Beispiel rot, seine konjugierte Base ist blau. Nach dem Prinzip des kleinsten Zwanges drängt eine hohe H+-Ionenkonzentration das Gleichgewicht nach links, man beobachtet die rote Farbe der Lackmus-Moleküle, HInd. Zusatz einer Base verringert die H+-Ionenkonzentration, das Gleichgewicht verlagert sich nach rechts, die blaue Farbe der Lackmus-Anionen Ind- erscheint.
Eine Pufferlösung enthält eine relativ hohe Konzentration einer schwachen Säure
und ihrer konjugierten Base.
Für eine Lösung, die eine schwache Säure und ihre konjugierte Base im
Stoffmengenverhältnis 1:1 enthält, gilt immer: pH = pKs .
Betrachten wir eine Pufferlösung, die aus einer Säure HA und ihrer konjugierten
Base A- hergestellt wird.
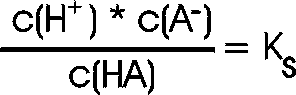
auflösen nach c(H+) -->
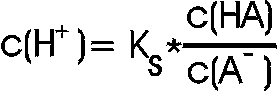
Daraus folgt, das der pH = pKs - log c(HA)/c(A-) . Damit die Pufferlösung wirksam ist, sollte das eingesetzte Stoffmengenverhältnis c(HA)/c(A-) im Bereich zwischen 1/10 und 10/1 liegen.
Pufferlösungen spielen eine wichtige Rolle bei vielen technischen Prozessen, z.B. beim Galvanisieren, Gerben von Leder, bei der Herstellung von Photos oder von Farbstoffen. Das Wachstum von Bakterien hängt sehr stark vom pH-Wert des Kulturmediums ab. Menschliches Blut wird durch ein Puffersystem aus Hydrogencarbonat, Phosphat und Proteinen auf einem pH-Wert von 7,4 gehalten.