| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Oxide können in das Schema eingefügt werden. Oxide, die mit Wasser Säuren bilden, werden Säureanhydride genannt. Oxide, die in wässriger Lösung Hydroxide (OH--Ionen) bilden, sind basische Oxide. Durch Reaktion von Säuren oder Säure- anhydriden mit Basen oder basischen Oxiden entstehen Salze.
Ein Nachteil des Arrhenius Konzeptes ist seine Beschränkung auf wässrige Lösungen. Später entwickelte Säure-Base-Konzepte sind allgemeiner anwendbar.
Danach ist eine Säure eine Substanz, die Protonen abgeben kann, ein Protonen-Donator.
Eine Base kann Protonen aufnehmen, sie ist ein Protonen-Akzeptor.
Hiernach besteht eine Säure-Base-Reaktion in der Übergabe von Protonen der Säure an die Base. Säuren und Basen können aus Molekülen oder Ionen bestehen.
Bei der Reaktion
spielt Essigsäure, CH3COOH, die Rolle der Säure; das Essigsäuremolekül gibt ein
Proton an das Wassermolekül ab, das die Funktion der Base übernimmt. Die
Reaktion ist reversibel, es stellt sich ein Gleichgewicht ein.
Bei der Rückreaktion gibt das H3O+-Ion ein Proton an das Acetat-Ion (CH3COO-) ab;
das H3O+-Ion wirkt als Säure, das Acetat-Ion als Base.
Im Ganzen sind also zwei Säuren, CH3COOH und H3O+, sowie zwei Basen, H2O und
CH3COO-, am Reaktionsgeschehen beteiligt. Die Reaktion kann als ein Wetteifern
der beiden Basen um das Proton aufgefaßt werden.
Bei der Hinreaktion nimmt die Base H2O ein Proton auf und wird zu der Säure H3O+,
bei der Rückreaktion gibt die Säure H3O+ ein Proton ab und wird zur Base H2O.
Ein solches Paar, das durch Aufnahme und Verlust eines Protons zusammengehört,
nennt man konjugiertes Säure-Base-Paar.
Entsprechend bilden CH3COOH und CH3COO- ein zweites konjugiertes Säure-Base-
Paar. Im System Essigsäure und Wasser stehen somit zwei konjugierte Säure-Base-
Paare miteinander im Gleichgewicht.
Es gibt viele Moleküle und Ionen, die sowohl als Säuren wie auch als Basen auftreten können. In der Reaktion mit Essigsäure tritt Wasser als Base auf. Gegenüber Ammoniak (NH3) verhält es sich dagegen als Säure. Dabei ist OH- die konjugierte Base zur Säure H2O. Ammoniak ist gegen Wasser eine Base. Substanzen, die sowohl als Säuren als auch als Basen auftreten können nennt man amphoter.
Die Neutralisationsreaktion ist nach Brönsted so zu interpretieren: Die konjugierte Säure und die konjugierte Base des amphoteren Lösungsmittels H2O bilden miteinander H2O.
Nach Brönsted ist die Säurestärke die Tendenz, Protonen abzugeben und die Basenstärke ist die Tendenz, Protonen aufzunehmen. HCl und H2O werden praktisch vollständig zu H3O+ und Cl- umgesetzt. Daraus muß man schließen, daß HCl eine stärkere Säure als H3O+ ist, denn es hat eine größere Tendenz, seine Protonen abzugeben; das Gleichgewicht liegt völlig auf der rechten Seite. H2O ist eine stärkere Base als Cl-, denn im Konkurrenzkampf um die Protonen schaffen es die Wassermoleküle, alle Protonen festzuhalten. Zur starken Säure HCl gehört eine schwache konjugierte Base Cl-.
Wegen der Tendenz einer starken Säure, Protonen abzugeben, ist ihre konjugierte Base notwendigerweise eine schwache Base mit geringer Tendenz, Protonen zu halten. Je stärker eine Säure, desto schwächer ist ihre konjugierte Base. Umgekehrt gilt, je stärker eine Base, desto schwächer ihre konjugierte Säure.
Die Reaktionen von Wasser mit HClO4, HCl oder HNO3 laufen praktisch vollständig ab. Jede dieser Säuren ist stärker sauer als H3O+, und im Gleichgewicht wird immer die schwächere Säure gebildet. Wässrige Lösungen von HClO4, HCl und HNO3 haben bei gleicher Konzentration gleiche Säurenstärke. Die sauren Eigenschaften der Lösung gehen auf H3O+-Ionen zurück. Wasser hat einen nivellierenden (ausgleichenden) Effekt auf Säuren, die stärker als H3O+ sind. Die stärkste Säure die im Wasser existieren kann, ist die zu H2O konjugierte Säure d.h. H3O+. Säuren, die schwächer sauer sind als H3O+, werden nicht nivelliert. Säuren wie CH3COOH, H3PO4, H2S können in Wasser in sehr unterschiedlichem Maße dissoziieren.
Wasser nivelliert auch Basen. Die stärkste Base, die in Wasser existieren kann, ist die zu H2O konjugierte Base, das OH-. Basen, die wie NH2- stärker basisch sind als OH-, nehmen in wässriger Lösung Protonen auf unter Bildung von OH--Ionen; diese Reaktionen laufen praktisch vollständig ab. Die Basenstärke von sehr starken Basen wird auf das Niveau des OH--Ions herabgesetzt.
Ein Atom eines stark elektronegativen Elementes entzieht dem Wasserstoffatom die Elektronen stärker und erleichtert seine Abspaltung als Proton.
Die Atomgröße ist von größerer Bedeutung. Ein Proton läßt sich viel leichter von einem großen als von einem kleinen Atom abziehen. Bei einem großen Atom ist die Valenzelektronenschale auf einem größeren Raum verteilt und das Proton deshalb weniger stark gebunden.
![]()
vor. Das Wasserstoffatom ist an ein Sauerstoffatom gebunden; dieses hat (fast) immer die gleiche Größe. Die Säurestärke wird in erster Linie von der Elektronegativität des Atoms Z abhängen.
Wenn Z ein Metallatom mit geringer Elektronegativität ist, wird das mit b bezeichnete Elektronenpaar zum Sauerstoff gehören. Die Verbindung ist dann ein ionisch aufgebautes Hydroxid wie zum Beispiel Na+OH-. Es entsteht eine typische Base.
Wenn Z ein Nichtmetallatom mit hoher Elektronegativität ist, ist die Bindung b eine
kovalente Bindung, die weniger leicht spaltbar ist. Das Z-Atom überläßt dem
Sauerstoff keine Elektronen sondern wird im Gegenteil dessen Elektronendichte
verringern, selbst dann wenn das Sauerstoffatom das elektronegativere Atom ist.
Dies wirkt sich auf die Bindung a aus. Das O-Atom übt einen Elektronenzug auf die
Elektronen der H-O -Bindung aus und erleichtert die Abspaltung des Protons. Ein
Beispiel ist die Hypochlorige Säure, HOCl.
Je elektronegativer das Z-Atom ist, desto mehr werden der O-H -Bindung Elektronen
entzogen und desto leichter läßt sich das Proton abspalten.
An das Z-Atom können weitere Sauerstoffatome gebunden sein. Bsp.:
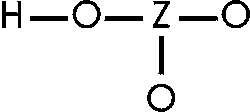
Die zusätzlichen O-Atome entziehen dem Z-Atom Elektronen(dichte) und machen es positiver. Damit zieht es seinerseits stärker die Elektronen des O-Atoms, das mit dem H-Atom verbunden ist, zu sich. Dieses O-Atom beansprucht deshalb die Elektronen der O-H -Bindung stärker für sich und erleichtert die Abspaltung des Protons. Je mehr O-Atome an das Z-Atom gebunden sind, desto stärker ist der Effekt, desto saurer ist die Verbindung.
Der Effekt von elektronenziehenden Gruppen läßt sich auch bei organischen Säuren verfolgen. Ethanol, CH3-CH2-OH, spaltet in wässriger Lösung kein Proton ab. Durch Einführung eines zweiten Sauerstoffatoms kommen wir zur Essigsäure, CH3COOH; das H-Atom der OH-Gruppe ist hier sauer. Viele organische Säuren gehören zur Gruppe der Carbonsäuren, in denen die Carboxylgruppe -COOH vorkommt; sie sind meist schwache bis mittelstarke Säuren.
Carbonsäuren haben die allgemeine Formel R-COOH, wobei R ein variabler Rest von Atomen ist. Änderungen im Aufbau von R können die Säurestärke beeinflussen. Wenn in der Essigsäure ein oder mehr der an das C-Atom gebundenen H-Atome durch elektronegativere Atome (z.B. Cl) ersetzt werden, nimmt die Säurestärke zu. Trichloressigsäure ist bedeutend stärker als Essigsäure.
Danach verfügt ein Teilchen (Molekül oder Ion) einer Base über ein freies
(einsames) Elektronenpaar, mit dem eine kovalente Bindung zu einem anderen
Atom, Molekül oder Ion geknüpft werden kann.
Ein Teilchen einer Säure kann sich an das Elektronenpaar eines Basenteilchens
unter Bildung einer kovalenten Bindung anlagern.
Die Betonung liegt auf der Bildung einer kovalenten Bindung zwischen Säure- und Base-Teilchen, wobei das Elektronenpaar für die Bindung jeweils von der Base zur Verfügung gestellt wird.
Die Base wirkt als Elektronenpaar-Donator, die Säure als Elektronenpaar-Akzeptor.
Eine Substanz, die nach Brönsted eine Base ist, ist auch eine Base im Lewis- Konzept. Bei den Säuren umfaßt die Lewis-Definition dagegen eine wesentlich größere Zahl von Substanzen. Ein Molekül einer Lewis-Säure muß eine „Elektronenlücke" haben, die mit dem Elektronenpaar der Base besetzt werden kann. Das Proton ist nur ein Beispiel für eine Lewis-Säure.
Zu den Lewis-Säuren sind folgende Substanzen zu zählen:
1.) Moleküle oder Atome mit unvollständigem Elektronenoktett (z.B.: BF3, AlCl3, S-Atome).
2.) Viele einfache Kationen sind als Lewis-Säuren aufzufassen (Cu2+, Fe3+).
3.) Die Atome mancher Metalle treten als Lewis-Säuren auf (Ni).
4.) Verbindungen deren Valenzschale über das Elektronenoktett hinaus aufgeweitet werden kann (SiF4, SnCl4, PF5 in Reaktion mit Basen wie F-, Cl-)
5.) Verbindungen mit „sauren Zentren" (dort herrscht eine geringe Elektronendichte).
Eine Brönsted-Säure-Base-Reaktion ist nach dem Lewis-Konzept eine Reaktion, bei der eine Base durch eine andere verdrängt wird. Bei der Reaktion
wird die an das Proton gebundene schwache Base Cl- durch die stärkere Base H2O verdrängt. Eine Base stellt einem Atomkern ein Elektronenpaar zur Verfügung; diese Eigenschaft wird als nucleophil („kernliebend") bezeichnet. H2O ist stärker nucleophil als Cl-. Eine Basenverdrängung ist eine nucleophile Verdrängungsreaktion.
Lewis-Säuren sind Elektronenpaar-Akzeptoren; sie sind elektrophil („elektronenliebend"). In einer elektrophilen Verdrängungsreaktion wird eine Lewis- Säure durch eine andere verdrängt.
Diese Art der Reaktion kommt seltener vor als die nucleophile Verdrängunsreaktion.