| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
Unter dem Lösungsmittel versteht man im allgemeinen die Komponente einer Lösung mit dem größten Mengenanteil; die übrigen Komponenten sind die gelösten Stoffe (diese Einteilung ist willkürlich und nicht immer zweckmäßig).
Manche Substanzen bilden miteinander Lösungen in jedem beliebigen Mischungsverhältnis. Gase sind immer beliebig mischbar und auch für manche Komponenten von flüssigen oder festen Lösungen gilt dies. Meistens jedoch, ist die Menge eines Stoffes, die sich in einem Lösungsmitte lösen läßt, begrenzt.
Wenn man einem flüssigen Lösungsmittel eine größere Menge eines Stoffes zufügt, als sich darin lösen kann, so stellt sich ein Gleichgewicht zwischen den Lösungen und dem ungelösten Rest des Stoffes ein. Der ungelöste Stoff kann fest, flüssig oder auch gasförmig sein. Im Gleichgewichtszustand geht ständig ungelöster Stoff in Lösung während gelöster Stoff gleich schnell aus der Lösung ausgeschieden wird. Die Konzentration in der Lösung bleibt daher konstant. Eine Lösung dieser Art wird gesättigte Lösung genannt, und die zugehörige Konzentration entspricht der Löslichkeit des entsprechenden Stoffes.
Allgemein lösen sich polare Substanzen nur in polaren Lösungsmitteln und unpolare nur in unpolaren Lösungsmitteln („ähnliches löst ähnliches").
Polare Lösungsmittel, insbesondere Wasser, vermögen viele Ionenverbindungen zu
lösen. Die Ionen ziehen die polaren Lösungsmittelmoleküle an - positiver Pol des
Lösungsmittels an negatives Ion, negativer Pol an positives Ion.
Ion-Dipol-Anziehungskräfte können recht stark sein, sie erlauben den Ionen aus
dem Kristallverband auszubrechen und in die Lösung zu driften. Die gelösten Ionen
sind hydratisiert, d.h. von einer Hülle aus Wassermolekülen umgeben. Diese Hülle
kann aus vielen Schichten von Wassermolekülen bestehen die dem Ion dadurch
einen erheblich größeren Radius vermitteln, als es eigentlich in reinem Zustand
hätte. Dies wiederum hat zur Folge das zum Beispiel stark geladene Ionen nicht
durch bestimmte biologische Ionenkanäle passen obwohl andere, die eigentlich
größer sind aber nicht so stark geladen, durchgehen. Die stärker geladenen Ionen
besitzen eine größere Hydrathülle (Hülle aus Wassermolekülen).
Eine gesättigte Lösung, die sich im Gleichgewicht mit ungelöstem Stoff (Bodenkörper) befindet, hat zur Herstellung der Lösung Energie nötig. Eine Erhöhung der Temperatur stellt einen Zwang dar, und nach dem Prinzip des kleinsten Zwanges weicht das System aus, indem ein Vorgang mit Wärmeaufnahme abläuft. Zur Herstellung der Lösung war Energie nötig ? wenn sich mehr Stoff aus dem Bodenkörper löst wird Wärme aufgenommen (Energie verbraucht). Bei Temperaturerniedrigung weicht das System aus, indem ein Vorgang mit Energieabgabe verläuft --> gelöster Stoff scheidet sich aus.( die meisten Ionenverbindungen verhalten sich so. )
Bei Substanzen, die unter Wärmeabgabe in Lösung gehen, ist die Situation genau umgekehrt. Die meisten Gase verhalten sich so. z.B.: Wenn ein Mineralwasser erhitzt wird verliert es seinen Gasanteil.
Beim Ausüben von Druck weicht das System nach dem Prinzip des kleinsten Zwanges aus, indem ein Vorgang abläuft, bei dem sich das Volumen verringert. Besonders gut ist dieses Verhalten bei Gasen zu beobachten. Bei Erhöhung des Druckes weicht das System aus, indem eine größere Gasmenge in Lösung geht. Umgekehrt, nimmt man aus einer Mineralwasserflasche den Druck (man schraubt sie auf) entweicht eine bestimmte Menge vorher gelösten Gases. Druckänderung hat auf flüssige oder feste Lösungsvorgänge nur geringen Einfluß.

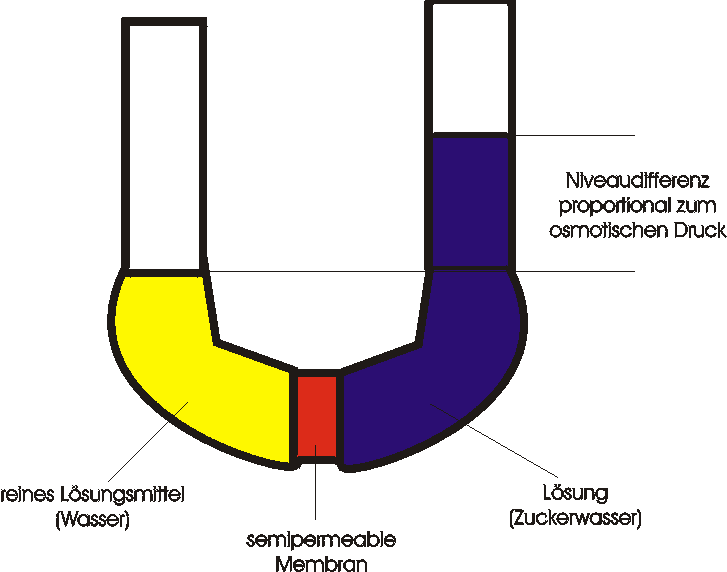
In der Abbildung ist eine Versuchsanordnung gezeigt, bei der sich eine für Wassermoleküle durchlässige aber für Zuckermoleküle undurchlässige Membran zwischen Wasser und einer wäßrigen Zuckerlösung befindet. Zu Beginn des Versuchs wurden beide Arme des U-Rohrs gleich hoch gefüllt. Wassermoleküle durchqueren die Membran in beiden Richtungen, nicht jedoch Zuckermoleküle. Auf der linken Seite (im reinen Wasser) befinden sich mehr Wassermoleküle pro Volumeneinheit als auf der rechten Seite (denn auf der rechten Seite befinden sich noch zusätzlich Zuckermoleküle pro Volumeneinheit). Die Zahl der Wassermoleküle, die die Membran von links nach rechts passieren, ist deshalb größer als in umgekehrter Richtung. Als Folge davon steigt die Flüssigkeitsmenge im rechten Arm des U-Rohres, und die Lösung darin verdünnt sich. Diese Erscheinung wird Osmose genannt.
Der Anstieg des Flüssigkeitsspiegels im rechten Arm des U-Rohres hat einen Anstieg des (hydrostatischen) Drucks in diesem Arm zur Folge. Der erhöhte Druck schiebt die Wassermoleküle, durch die Membran hindurch, von der rechten auf die linke Seite. Wenn die Druckdifferenz einen Wert erreicht hat, bei dem der Wasserfluß durch die Membran in beiden Richtungen gleich groß ist, herrscht ein Gleichgewicht vor. Die Druckdifferenz, die sich aus der Höhendifferenz der Flüssigkeitsspiegel links und rechts ergibt, wird der osmotische Druck genannt.
Definition aus dem Schülerduden Chemie:
Osmose, einseitig verlaufender Diffusionsvorgang, der Auftritt, wenn zwei
gleichartige Lösungen unterschiedlicher Konzentration durch eine semipermeable
Membran getrennt sind. Durch diese können nur Moleküle des Lösungsmittels von
einer Lösung in die andere hindurchdiffundieren, der gelöste Stoff, dessen
Moleküle bzw. Ionen zu groß sind, wird zurückgehalten. Dabei diffundieren mehr
Moleküle des Lösungsmittels in den Bereich höherer Konzentration als umgekehrt,
es besteht also die Tendenz, daß die Konzentrationen der Lösungsmittelmoleküle
einander angeglichen werden.
Die höher konzentrierte Lösung wird so lange verdünnt, bis gleich viele
Lösungsmittelmoleküle in beide Richtungen diffundieren. Der dann auf der Seite
der schwächer konzentrierten Lösung herrschende Überdruck wird osmotischer
Druck genannt. Er ist um so höher, je größer die Konzentrationsunterschiede sind.
Die Osmose spielt eine wichtige Rolle bei physiologischen Prozessen in Pflanzen
und Tieren. Der Stoffdurchgang durch die semipermeablen Zellwände oder die
Funktion der Nieren sind Beispiele.
Weil die Zellen einer Pflanze (nicht verholzt) durch den osmotischen Druck
aufgeblasen sind, steht eine Pflanze aufrecht, obwohl das Gewebematerial nicht
steif ist.
Rote Blutkörperchen (Erythrozyten) sind Zellen mit semipermeablen Wänden. Wenn
sie in reines Wasser gebracht werden, kommt es zu einem Wasserfluß in das Innere
der Zelle; der hydrostatische Druck in der Zelle steigt, bis sie platzt. In einer
konzentrierten Zuckerlösung kommt es umgekehrt zu einem Wasserfluß aus der
Zelle, die Zelle schrumpft.
Eine Lösung aus zwei und mehr flüchtigen Komponenten kann durch fraktionierte
Destillation getrennt werden.
Bei der Destillation einer Flüssigkeit aus A und B wird ein Dampf und aus diesem ein
Kondensat erhalten, in dem A, aufgrund seines niedrigeren Dampfdruckes
(entspricht ? niedrigerer Sdp.), angereichert ist. In der zurückgebliebenen, nicht
verdampften Flüssigkeit hat sich der Anteil von B angereichert (aufgrund seines
höheren Dampfdruckes oder auch höherer Sdp.). Sowohl diese Flüssigkeit als auch
das Kondensat können durch weitere Destillationsschritte weiter getrennt werden,
bis sie praktisch rein sind (< 99,9%).
Manche Lösungen erhalten durch ihre Vermischung einen neuen Dampfdruck
(Siedepunkt) der unter denen der Einzelkomponenten der Lösung liegt. Solch eine
Lösung ist über Destillation nicht zu trennen, denn die Lösung selbst verdampft
bevor die Einzelkomponenten verdampfen. Solche Lösungen nennt man azeotrope
Gemische.
Alkohol kann über Destillation nur bis zu einem Reinheitsgrad von 96% erhalten
werden. Ethanol (Alk.) bildet mit Wasser ein azeotropes Gemisch, das 4% Wasser
enthält und bei 78,17°C siedet; reiner Alkohol (technisch gewonnen) siedet bei
78,3°C und Wasser bei 100°C.
Ein Elektrolyt ist ein Stoff, dessen wäßrige Lösung den elektrischen Strom besser
leitet als reines Wasser. Ein Elektrolyt liegt in der wäßrigen Lösung teilweise oder
vollständig in Form von Ionen vor.
Starke Elektrolyte liegen in wäßriger Lösung praktisch vollständig in Form von
Ionen vor.
Schwache Elektrolyten bestehen aus polaren Molekülen, die in wäßriger Lösung
teilweise in Ionen gespalten werden.
Bei gleicher Stoffmengenkonzentration leitet ein starker Elektrolyt den Strom besser
als ein schwacher Elektrolyt.