| Bio-Ecke | Chemie-Ecke | Home | Unterricht | sOWLrebel |
|---|
1. Elemente bestehen aus extrem kleinen Teilchen, den Atomen. Alle Atome eines Elementes sind gleich (aber: beachte Isotope) und die Atome verschiedener Elemente sind verschieden.
2. Bei chemischen Reaktionen werden Atome miteinander verbunden oder voneinander getrennt. Dabei werden nie Atome zerstört oder neu gebildet und kein Atom eines Elementes wird in das eines anderen Elementes verwandelt.
3. Eine chemische Verbindung resultiert aus der Verknüpfung der Atome von zwei oder mehr Elementen. Eine gegebene Verbindung enthält immer die gleichen Atomsorten, die in einem festen Mengenverhältnis miteinander verknüpft sind.
Im Laufe der Zeit konnte der von Dalton geprägte Begriff des Atoms mit Inhalt gefüllt werden.
Versuche mit der Elektrizität ließen erkennen, dass die Atome selbst aus noch kleineren Teilchen aufgebaut sein mussten.
Ladung des Elektrons: q = -e = -1,6022*10-19 C
Masse des Elektrons: m = 9,1096*10-28 g
Ladung des Protons: q = +e = 1,6022*10-19 C
Masse des Protons: m = 1,6726*10-24 g
|
|
Gramm |
Atommassen-Einheiten |
Ladung |
|
Elektron |
9,109*10-28 |
0,0005 |
-1 |
|
Proton |
1,672*10-24 |
1,0072 |
+1 |
|
Neutron |
1,674*10-24 |
1,0086 |
0 |

α, β und γ-Strahlung.
Alpha-Strahlen (α) bestehen aus Teilchen mit zwei Protonen und zwei Neutronen. Sie ähneln dadurch einem Helium-Atom ohne Elektronen. (10.000 - 30.000 km/s)Beta-Strahlen (β) bestehen aus Elektronen (130.000 km/s)
Gamma-Strahlen (γ) sind elektromagnetische Strahlen ähnlich wie Röntgenstrahlen.
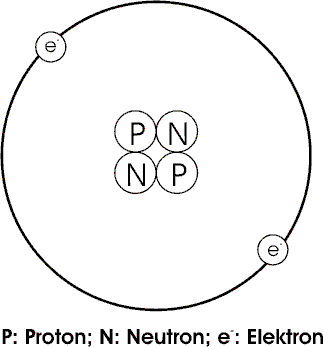
1. Im Mittelpunkt der Atome befindet sich ein Atomkern. Fast die gesamte Atommasse und die ganze positive Ladung befindet sich im Atomkern. Er besteht aus Protonen und Neutronen, die zusammen die Masse des Kerns ausmachen, aber nur die Protonen bestimmen seine Ladung (positiv). Trotz gleicher Ladung werden die Protonen durch die "starke Kernkraft" zusammengehalten.
2. Elektronen nehmen fast das gesamte Volumen des Atoms ein. Sie befinden sich außerhalb des Atomkerns und umkreisen ihn in schneller Bewegung. Damit das Atom elektrisch neutral ist entspricht die Zahl der Elektronen der Zahl der Protonen im Kern.
Der Atomkern ist sehr klein, sein Durchmesser liegt bei 1 fm. Der Durchmesser des Atoms beträgt dagegen 100-400 pm und ist somit ca. 100.000 mal größer als der Atomkern.
Stabile Atomkerne enthalten etwa genauso viele bis 1,5 mal so viele Neutronen wie Protonen.
Die Ordnungszahl Zentspricht der Zahl der Protonen im Kern. In einem neutralen Atom ist außerdem die Zahl der Elektronen gleich der Ordnungszahl.
Die Massenzahl A gibt die Gesamtzahl der Nukleonen, d.h. der Protonen und Neutronen zusammen an.
Die Massenzahl entspricht näherungsweise der Atommasse in Atommasseneinheiten u, denn Proton und Neutron haben etwa eine Masse von 1 u und die Masse der Elektronen ist vernachlässigbar.
Ein Atom eines Elements wird durch das chemische Symbol für das Element bezeichnet, unter Voranstellung der Ordnungszahl links unten und der Massenzahl links oben.
Für die chemischen Eigenschaften eines Atoms ist seine Ordnungszahl (Zahl der Elektronen, die "äußere Gestalt") maßgeblich, während seine Masse kaum eine Rolle spielt. Alle Atome eines Elements haben die gleiche Ordnungszahl.
Bei einigen Elementen kommen allerdings unterschiedliche Atome vor, die sich in ihrer Massenzahl unterscheiden. Diese nennt man Isotope.
Die unterschiedliche Massezahl, ergibt sich aus einer unterschiedlichen
Anzahl von Neutronen. Zum Beispiel kennt man vom Chlor Isotope mit jeweils
17 Protonen und Elektronen sowie einmal 18 Neutronen und ein anderes mal mit 20 Neutronen.
Beide Isotope verhalten sich chemisch völlig gleich.
Von manchen Elementen findet man in der Natur nur ein Isotop (z.B.: Natrium). Die meisten natürlichen Elemente bestehen jedoch aus Gemischen mehrere Isotope.
Wegen ihrer geringen Masse kann man einzelne Atome nicht wiegen, man kann allerdings ihre relativen Massen untereinander bestimmen; d.h. man sucht sich ein Element aus und prüft, wie viel mal die anderen Elemente schwerer oder leichter sind.
Dalton wählte den Wasserstoff als Bezugselement und konnte feststellen das z.B. Kohlenstoff 12 mal schwerer und Sauerstoff 16 mal schwerer als Wasserstoff ist.
Heute bezieht man die Massen auf das Kohlenstoff-Atom. Die Atommasseneinheit u ist als ein Zwölftel der Masse dieses Kohlenstoff-Atoms definiert.
Isotopengemische:
Natürliches Chlor kommt zu 75,77 % mit 18 Neutronen vor und zu
24,23 % mit 20 Neutronen. Diesem Gemisch wird eine mittlere Atommasse zugeteilt.
Die Masse eines Atoms ergibt sich nicht einfach aus der Summe seiner Elektronen, Protonen und Neutronen, sondern sie ist immer etwas kleiner. Nach Einstein lassen sich Masse und Energie in einander umwandeln. Die fehlende Masse wird Maßendeffekt genannt; sie entspricht der Bindungsenergie des Atomkerns. Wollte man den Atomkern auseinanderreißen müsste man die dem Massendefekt entsprechende Energie dazu aufwenden.